题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
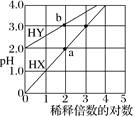
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为__________。
(2)已知常温时CH3COOH![]() CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O![]() CH3COOH + OH–的平衡常数Kh=______。
CH3COOH + OH–的平衡常数Kh=______。
(3)已知H2A在水中发生电离:H2A=H++HA–,HA–![]() H++A2–。
H++A2–。
① 等物质的量浓度的两种溶液:NaHA溶液的pH_____(填“>”、“=”或“<”)Na2A溶液的pH。
② 已知0.1 mol·L-1 NaHA溶液的pH=2,该溶液中各种离子浓度由大到小的顺序是______。
③某温度下,若向0.1 mol·L–1的NaHA溶液中逐滴滴加0.1 mol·L–1 NaOH溶液至溶液呈中性。对该混合溶液,下列说法一定正确的是____(填序号)。
A.c(H+)·c(OH–)=1×10–14 B.c(Na+)=c(HA–)+2c(A2–)
C.溶液中水的电离程度逐渐减小 D.c(Na+)=c(HA–)+c(A2–)
(4)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
【答案】MOH![]() M+ + OH 5×10–10 < c(Na+)>c(HA)>c(H+)>c(A2)>c(OH) B 2.2×10–8
M+ + OH 5×10–10 < c(Na+)>c(HA)>c(H+)>c(A2)>c(OH) B 2.2×10–8
【解析】
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,所得物质为MCl,测得混合后MCl溶液的pH=5,由此可知该碱为弱碱;
(2)结合水的离子积常数和水解平衡常数求算公式计算;
(3)①由H2A=H++HA–,HA–![]() H++A2–可知NaHA该盐为强酸强碱盐,Na2A为强碱弱酸盐,可以利用盐类水解的规律求解;
H++A2–可知NaHA该盐为强酸强碱盐,Na2A为强碱弱酸盐,可以利用盐类水解的规律求解;
②由0.1 mol·L-1 NaHA溶液的pH=2可知,该溶液中主要存在HA–![]() H++A2–,可以据此回答;
H++A2–,可以据此回答;
③由溶液呈中性可知溶液中氢离子的浓度等于氢氧根的浓度;
(4)结合Ksp[Cu(OH)2]=2.2×10–20进行计算求解;
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,所得物质为MCl,测得混合后MCl溶液的pH=5,由此可知该碱为弱碱,故MOH在水中的电离方程式为MOH![]() M+ + OH;
M+ + OH;
(2)![]() =5×10–10
=5×10–10
(3)①由H2A=H++HA–可知NaHA该盐为强酸强碱盐,故该盐为中性盐溶液的PH=7,Na2A为强碱弱酸盐,故溶液呈碱性PH>7,故答案为“<”;
②由题中信息可知溶液中c(Na+)=0.1 mol·L-1>c(HA-),溶液中存在HA–![]() H++A2–,
H++A2–,![]() 可知:c(Na+)>c(HA)>c(H+)>c(A2)>c(OH);
可知:c(Na+)>c(HA)>c(H+)>c(A2)>c(OH);
③溶液呈中性可知![]() ,则可知:
,则可知:
A.c(H+)·c(OH–)=kw由于温度未知,故数值不能确定;
B.由电荷守恒可知c(Na+)+c(H+)=c(HA–)+2c(A2–)+c(OH-)又![]() ,故c(Na+)=c(HA–)+c(A2–);
,故c(Na+)=c(HA–)+c(A2–);
C.0.1 mol·L-1 NaHA溶液的pH=2,由此可知最初溶液呈现酸性是HA–![]() H++A2–,抑制水的电离,故随着加入碱发生中和反应,水的电离程度逐渐增大;
H++A2–,抑制水的电离,故随着加入碱发生中和反应,水的电离程度逐渐增大;
D.由B可知D选项错误;
(4)由Ksp[Cu(OH)2]=![]() =2.2×10–20可知c(Cu2+)=2.2×10–8
=2.2×10–20可知c(Cu2+)=2.2×10–8

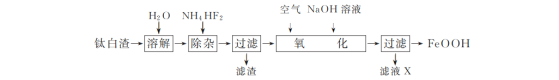
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
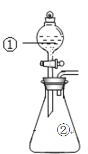
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 |
C. | 氯化铵溶液 | 氢氧化镁沉淀 | 白色沉淀溶解 |
D. | 碳酸氢钠溶液 | 苯酚钠溶液 | 溶液变浑浊 |
A.AB.BC.CD.D