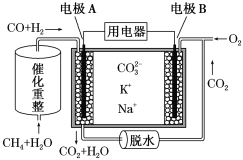
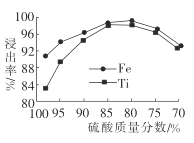
题目内容
【题目】实验室通常用图所示的装置来制取氨气。请按要求回答下列问题:
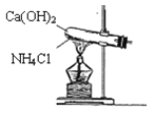
(1)实验室制取氨气的化学反应方程式为__。
(2)除了以上方法。下面也能用于制备氨气的是___。
①固态氯化铵加热分解
②浓氨水中加入固体氢氧化钠
③加热浓氨水
(3)NH3的催化氧化的化学反应方程式为__。
(4)①用装置A收集氨气时,应选择氨气的进气口是___(选填“a”或“b”),并说明选择的理由___。
②打开装置A中的止水夹,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是___、___。
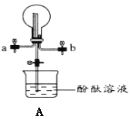
(5)通常可以用什么方法来检验无色溶液中是否有NH4+___。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2 +2H2O+2NH3↑ ②③ 4NH3+5O2
CaCl2 +2H2O+2NH3↑ ②③ 4NH3+5O2 ![]() 4NO+6H2O a 氨气的密度比空气密度小 氨气极易溶于水 氨气与水反应生成碱 加入强碱并加热,生成的气体能使湿润的红色石蕊试纸变蓝
4NO+6H2O a 氨气的密度比空气密度小 氨气极易溶于水 氨气与水反应生成碱 加入强碱并加热,生成的气体能使湿润的红色石蕊试纸变蓝
【解析】
(1)在加热条件下,氯化铵和氢氧化钙反应生成氨气、氯化钙和水;
(2)①固态氯化铵加热分解生成氯化氢和氨气,在试管口遇冷后又生成氯化铵,则无法制取氨气;
②浓氨水中加入固体氢氧化钠,NaOH溶于水放出大量热,放出的热量促进一水合氨分解而生成氨气,能制取氨气;
③加热浓氨水,能使氨气从氨水中逸出,制取到氨气;
(3)在催化剂加热条件下,NH3与O2反应生成NO和水;
(4)①氨气的密度小于空气,冲入的氨气占据容器的上部;
②氨气易溶于水,使容器内压强迅速减小,形成喷泉实验;溶液显红色,则溶液显碱性;
(5)NH3能使湿润的红色石蕊试纸变蓝色。
(1)在加热条件下,氯化铵和氢氧化钙反应生成氨气、氯化钙和水,反应方程式为Ca(OH)2+2NH4Cl![]() CaCl2 +2H2O+2NH3↑;
CaCl2 +2H2O+2NH3↑;
(2)①固态氯化铵加热分解生成氯化氢和氨气,在试管口遇冷后又生成氯化铵,则无法制取氨气;
②浓氨水中加入固体氢氧化钠,NaOH溶于水放出大量热,温度升高导致氨气的溶解度降低,能制取氨气;
③加热浓氨水,能使氨气从氨水中逸出,制取到氨气;
答案为②③;
(3)在催化剂加热条件下,NH3与O2反应生成NO和水,4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(4)①氨气的密度小于空气,充入的氨气占据容器的上部,则应从a进b出;
②氨气易溶于水,使容器内压强迅速减小,形成喷泉实验;溶液显红色,则溶液显碱性;
(5)NH3能使湿润的红色石蕊试纸变蓝色,可以向溶液中加入强碱并加热的条件下生成使湿润的红色试纸变蓝色的气体检验NH4+的存在。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。