题目内容
【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。
【答案】PbSO4 酸雨 调节溶液的pH使Fe3+沉淀完全 酒精(或饱和硫酸锌溶液) Zn+Cd2+= Zn2++Cd 在氧化除杂工序中加ZnO是为了调节溶液pH,若要完全除去Cd2+,溶液的pH至少需要调节为9.4,此时Zn2+也会完全沉淀 Ni(OH)2-e- +OH- = NiO(OH)+H2O 酸浸 5Fe2+ + 5AsO33- +3MnO4- + 14H+ = 3Mn2+ +5FeAsO4↓+7H2O
【解析】
焙烧过程中发生的反应有2ZnS+3O2![]() 2ZnO+2SO2、4FeS+7O2
2ZnO+2SO2、4FeS+7O2![]() 2Fe2O3+4SO2、2PbS+3O2
2Fe2O3+4SO2、2PbS+3O2![]() 2PbO+2SO2、2CdS+3O2
2PbO+2SO2、2CdS+3O2![]() 2CdO+2SO2,焙烧过程中生成的气体是SO2,焙烧后的主要成分变为ZnO,还存在少量的SiO2、Fe2O3、PbO、CdO,加稀硫酸后,发生一系列反应,ZnO、Fe2O3、PbO、CdO与稀硫酸反应分别生成硫酸锌、硫酸铁、硫酸铅、硫酸镉,其中SiO2和PbSO4不溶于水,以沉淀的形式沉降下来,所以滤渣1的主要成分是SiO2和PbSO4,氧化除杂工序中加入ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转化为氢氧化铁沉淀,且不引入杂质,加入酸性高锰酸钾溶液能使溶液中的Fe2+转变为Fe3+,有利于除杂,同时根据第(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,可知滤渣2为Fe(OH)3、FeAsO4,由第(4)问可知,还原除杂工序加入锌粉,可以还原Cd2+为金属Cd,则滤渣3为Cd以及过量的锌粉,则得到的滤液为含硫酸锌的溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到ZnSO4·7H2O,经过电解得到金属Zn,据此分析解答。
2CdO+2SO2,焙烧过程中生成的气体是SO2,焙烧后的主要成分变为ZnO,还存在少量的SiO2、Fe2O3、PbO、CdO,加稀硫酸后,发生一系列反应,ZnO、Fe2O3、PbO、CdO与稀硫酸反应分别生成硫酸锌、硫酸铁、硫酸铅、硫酸镉,其中SiO2和PbSO4不溶于水,以沉淀的形式沉降下来,所以滤渣1的主要成分是SiO2和PbSO4,氧化除杂工序中加入ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转化为氢氧化铁沉淀,且不引入杂质,加入酸性高锰酸钾溶液能使溶液中的Fe2+转变为Fe3+,有利于除杂,同时根据第(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,可知滤渣2为Fe(OH)3、FeAsO4,由第(4)问可知,还原除杂工序加入锌粉,可以还原Cd2+为金属Cd,则滤渣3为Cd以及过量的锌粉,则得到的滤液为含硫酸锌的溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到ZnSO4·7H2O,经过电解得到金属Zn,据此分析解答。
焙烧过程中发生的反应有2ZnS+3O2![]() 2ZnO+2SO2、4FeS+7O2
2ZnO+2SO2、4FeS+7O2![]() 2Fe2O3+4SO2、2PbS+3O2
2Fe2O3+4SO2、2PbS+3O2![]() 2PbO+2SO2、2CdS+3O2
2PbO+2SO2、2CdS+3O2![]() 2CdO+2SO2,焙烧过程中生成的气体是SO2,焙烧后的主要成分变为ZnO,还存在少量的SiO2、Fe2O3、PbO、CdO,加稀硫酸后,发生一系列反应,ZnO、Fe2O3、PbO、CdO与稀硫酸反应分别生成硫酸锌、硫酸铁、硫酸铅、硫酸镉,其中SiO2和PbSO4不溶于水,以沉淀的形式沉降下来,所以滤渣1的主要成分是SiO2和PbSO4,氧化除杂工序中加入ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转化为氢氧化铁沉淀,且不引入杂质,加入酸性高锰酸钾溶液能使溶液中的Fe2+转变为Fe3+,有利于除杂,同时根据第(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,可知滤渣2为Fe(OH)3、FeAsO4,由第(4)问可知,还原除杂工序加入锌粉,可以还原Cd2+为金属Cd,则滤渣3为Cd以及过量的锌粉,则得到的滤液为含硫酸锌的溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到ZnSO4·7H2O,经过电解得到金属Zn,
2CdO+2SO2,焙烧过程中生成的气体是SO2,焙烧后的主要成分变为ZnO,还存在少量的SiO2、Fe2O3、PbO、CdO,加稀硫酸后,发生一系列反应,ZnO、Fe2O3、PbO、CdO与稀硫酸反应分别生成硫酸锌、硫酸铁、硫酸铅、硫酸镉,其中SiO2和PbSO4不溶于水,以沉淀的形式沉降下来,所以滤渣1的主要成分是SiO2和PbSO4,氧化除杂工序中加入ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转化为氢氧化铁沉淀,且不引入杂质,加入酸性高锰酸钾溶液能使溶液中的Fe2+转变为Fe3+,有利于除杂,同时根据第(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,可知滤渣2为Fe(OH)3、FeAsO4,由第(4)问可知,还原除杂工序加入锌粉,可以还原Cd2+为金属Cd,则滤渣3为Cd以及过量的锌粉,则得到的滤液为含硫酸锌的溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到ZnSO4·7H2O,经过电解得到金属Zn,
(1)由以上分析可知,滤渣1的主要成分除SiO2外还有PbSO4;焙烧后产生的气体为SO2,其对环境造成的常见危害为酸雨,故答案为:PbSO4;酸雨;
(2)由以上分析知,氧化除杂工序中加入ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转化为氢氧化铁沉淀,且不引入杂质,故答案为:调节溶液的pH使Fe3+沉淀完全;
(3)已知ZnSO4·7H2O易溶于水,难溶于酒精,则为了减少洗涤过程中晶体的损失,可以用酒精或者饱和硫酸锌溶液洗涤晶体,故答案为:酒精(或饱和硫酸锌溶液);
(4)还原除杂工序加入锌粉,可以还原Cd2+为金属Cd,从而除去Cd,发生反应的离子方程式为Zn+Cd2+= Zn2++Cd;根据Cd2+、Zn2+沉淀的pH可知,若直接在“氧化除杂”步骤中除去Cd2+,溶液的pH至少需要调节为9.4,此时Zn2+也会完全沉淀,因此需要在“还原除杂”步骤中除去Cd2+,故答案为:Zn+Cd2+= Zn2++Cd;在氧化除杂工序中加ZnO是为了调节溶液pH,若要完全除去Cd2+,溶液的pH至少需要调节为9.4,此时Zn2+也会完全沉淀;
(5)电池工作时,正极NiO(OH)转化为Ni(OH)2,则放电时,正极反应式为:NiO(OH)+H2O+ e- = Ni(OH)2 +OH-,充电时,阳极发生的反应为放电时正极反应的逆过程,则阳极反应式为:Ni(OH)2-e- +OH- = NiO(OH)+H2O;电解硫酸锌溶液制备锌单质时,阴极锌离子得电子析出金属锌,阳极为水电离出的氢氧根离子放电,电极反应式为:2H2O-4e- =O2↑+4H+,则电解后溶液生成稀硫酸,所以沉积锌后的电解液可返回酸浸工序继续使用,故答案为:Ni(OH)2-e- +OH- = NiO(OH)+H2O;酸浸;
(6)已知酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,As的化合价根据得失电子守恒,电荷守恒、元素守恒,写出该反应的离子方程式为5Fe2+ + 5AsO33- +3MnO4- + 14H+ = 3Mn2+ +5FeAsO4↓+7H2O,故答案为:5Fe2+ + 5AsO33- +3MnO4- + 14H+ = 3Mn2+ +5FeAsO4↓+7H2O。

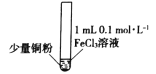
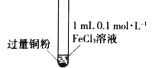
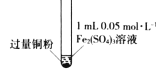
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:

①P4S3分子中硫原子的杂化轨道类型为___。
②1molP4S3分子中含有的孤电子对的数目为___对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为___。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___。
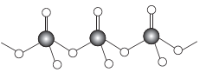
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
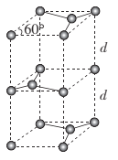
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___cm。