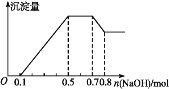
题目内容
【题目】下列反应的离子方程式的书写正确的是
A.氢氧化钡溶液与稀硫酸反应:SO![]() + Ba2+ = BaSO4 ↓
+ Ba2+ = BaSO4 ↓
B.将氯气通入氯化亚铁溶液中:Cl2+2Fe2+=2Fe3++2Cl![]()
C.用FeCl3溶液蚀刻印刷电路板上的Cu:2Fe3++3Cu=2Fe+3Cu2+
D.硫酸与碳酸氢钠溶液反应:2H++CO![]() =H2O+ CO2↑
=H2O+ CO2↑
【答案】B
【解析】
A.氢氧化钡和稀硫酸反应除了生成沉淀以外,还有酸碱中和,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,A项错误;
B.氯气具有强氧化性,将Fe2+氧化为Fe3+,自身被还原为![]() ,B项正确;
,B项正确;
C.![]() 与铜反应的还原产物是
与铜反应的还原产物是![]() 而不是单质铁,C项错误;
而不是单质铁,C项错误;
D. 碳酸氢钠是弱酸酸式盐,不能拆成![]() 的形式,反应的离子方程式为HCO3-+H+=H2O+CO2↑,D项错误;
的形式,反应的离子方程式为HCO3-+H+=H2O+CO2↑,D项错误;
答案选B。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】对于如下反应,其反应过程的能量变化示意图如图:
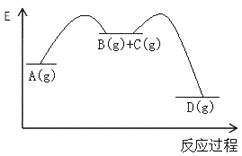
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g)=B(g)+C(g) | K1 | △H1 |
反应② | B(g)+C(g)=D(g) | K2 | △H2 |
反应③ | A(g)= D(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快D.则增大压强,K1减小,K2增大,K3不变
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如图:
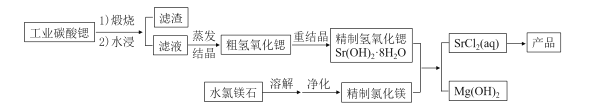
(1)锶与钙同主族。金属锶应保存在__中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为___。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是___。
(4)“重结晶”时蒸馏水用量[以质量比m(H2O):m(SrO)表示]对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为___,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是___。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式___
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为___。