题目内容
【题目】材料的不断发展可以促进社会进步。 完成下列填空:
(1) “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是____________________。(任写一点)
(2)光导纤维简称“光纤”,是一种由玻璃制成、能传输光线、结构特殊的玻璃纤维。现在家中的电话线和网线大都采用光纤线。光纤的主要成分是二氧化硅,二氧化硅的晶体类型是____________________。(单选)
a.金属晶体 b.离子晶体 c.原子晶体 d.分子晶体
(3)随着我国经济的快速发展,对电池新材料需求的不断增加,再加上手机、笔记本电脑、数码相机、摄像机、汽车等产品对新型、高效、环保电池材料的强劲需求,我国电池新材料市场将不断扩大。而铜锌原电池是一种最基本的将化学能转变为电能的装置,其中铜作________极,锌作_________极。
(4)塑料制品作为一种新型材料,具有质轻、防水、耐用、生产技术成熟、成本低的优点,在全世界被广泛应用且呈逐年增长趋势。乙烯通过加聚反应可以制成聚乙烯塑料,请写出聚乙烯的结构简式____________________。
【答案】密度小 / 强度大 / 耐腐蚀 C 正 负 ![]()
【解析】
⑴镁铝合金的优点是密度小,强度大,耐腐蚀,故答案为密度小/强度大/耐腐蚀;
⑵二氧化硅的晶体是由原子构成原子晶体,故答案为C;
⑶铜锌原电池中金属活泼性强的为负极,金属活泼性较弱的为正极,所以铜作正极,锌作负极,故答案为正;负。
⑷乙烯通过加聚反应可以制成聚乙烯,其产物为聚乙烯![]() ,故答案为
,故答案为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
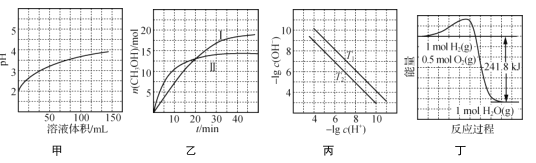
小学生10分钟应用题系列答案【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如图:
(1)锶与钙同主族。金属锶应保存在__中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为___。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是___。
(4)“重结晶”时蒸馏水用量[以质量比m(H2O):m(SrO)表示]对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为___,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是___。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式___
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为___。
【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:
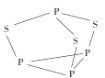
①P4S3分子中硫原子的杂化轨道类型为___。
②1molP4S3分子中含有的孤电子对的数目为___对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为___。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___。

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
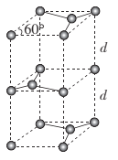
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___cm。