题目内容
【题目】磷化硼(BP)是一种受到高度关注的金属保护层耐磨材料,可由三溴化硼和三溴化磷在氢气中高温制得。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为____,核外电子数最多的元素的基态原子电子占据最高能级上的电子数为____。B所在的周期第一电离能最大的元素名称为____。
(2)三溴化磷分子的中心原子价层电子对数为____,分子空间结构为____形。BBr3空间结构为____形,PBr3分子中键角比BBr3分子中键角____(填>、<或=)。
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJmol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJmol-1,这种固体高聚氮可能潜在的用途是____,这是因为____。
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为____,已知晶胞参数a=478pm,则硼和磷原子的核间距为____pm(保留整数)。
【答案】P 5 氖 4 三角锥 平面三角形 < 炸药(或高能材料) 固体高聚氮断开2molN-N键,结合成氮分子,且断裂2molN-N键消耗320kJ,生成1mol氮氮三键放出942kJ,因此这是个剧烈放热且剧烈熵增(产生大量气体)的反应。 50% 207
【解析】
(1)根据B、P、Br的核外电子排布式,判断出基态原子未成对电子最多的元素、核外电子数最多的元素的基态原子电子占据最高能级上的电子数;
(2)结合ABn型分子的中心原子的价层电子对数=![]() 键数+孤电子对数,结合中心原子上的孤电子对数,判断出ABn型分子的中心原子的杂化类型,以及分子空间构型;
键数+孤电子对数,结合中心原子上的孤电子对数,判断出ABn型分子的中心原子的杂化类型,以及分子空间构型;
(3)结合旧键断裂吸收能量,新键形成释放能量,依据题中给的数据进行相关计算;
(4)金属铜为面心立方堆积,面心立方晶胞中存在8个四面体空隙,结合BP的化学式,计算出B原子填隙率;根据硼和磷原子的核间距为晶胞体对角线的![]() ,结合晶胞参数,计算出体对角线。
,结合晶胞参数,计算出体对角线。
(1)基态B原子核外电子排布式1s22s22p1,基态P原子核外电子排布式为1s22s22p63s23p3,基态溴原子的核外电子排布式为[Ar]3d104s24p5,根据洪特规则,基态原子未成对电子最多的元素符号为P,核外电子数最多的元素是Br,占据最高能级上的电子数为5;B在元素周期表中位于第二周期,第二周期第一电离能最大的元素是Ne,其核外电子排布为全充满结构;
(2)三溴化磷分子的中心原子价层电子对数=![]() 键数+孤电子对数,1个PBr3分子中含有3个
键数+孤电子对数,1个PBr3分子中含有3个![]() 键,中心P原子上的孤电子对数为1,故三溴化磷分子的中心原子价层电子对数为4,PBr3分子空间结构为三角锥形;BBr3分子的中心原子价层电子对数3,并且中心原子上不含孤电子对,故BBr3空间结构为平面三角形,PBr3分子中P原子的杂化方式为sp3杂化,BBr3分子中的B的杂化方式为sp2杂化,故PBr3分子中键角比BBr3分子中键角小;
键,中心P原子上的孤电子对数为1,故三溴化磷分子的中心原子价层电子对数为4,PBr3分子空间结构为三角锥形;BBr3分子的中心原子价层电子对数3,并且中心原子上不含孤电子对,故BBr3空间结构为平面三角形,PBr3分子中P原子的杂化方式为sp3杂化,BBr3分子中的B的杂化方式为sp2杂化,故PBr3分子中键角比BBr3分子中键角小;
(3)结合题中的数据信息,固体高聚氮断开2molN-N键,结合成氮分子,且断裂2molN-N键消耗320kJ,生成1mol氮氮三键放出942kJ,因此这是个剧烈放热且剧烈熵增(产生大量气体)的反应,故固体高聚氮可以用作炸药(或高能材料);
(4)金属铜为面心立方堆积,面心立方晶胞中存在8个四面体空隙,倘若被B原子全部填充,则不符合磷化硼的化学组成,据化学式BP可知B原子填隙率仅为50%,其晶胞结构如图所示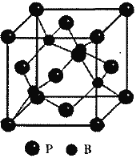 ,已知晶胞参数a=478pm,则晶胞的体对角线长为
,已知晶胞参数a=478pm,则晶胞的体对角线长为![]() ,晶胞中硼和磷原子的核间距为体对角线的
,晶胞中硼和磷原子的核间距为体对角线的![]() ,所以晶胞中硼和磷原子的核间距为
,所以晶胞中硼和磷原子的核间距为![]() 。
。

【题目】对于如下反应,其反应过程的能量变化示意图如图:
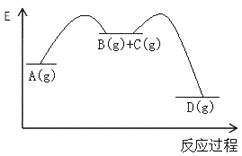
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g)=B(g)+C(g) | K1 | △H1 |
反应② | B(g)+C(g)=D(g) | K2 | △H2 |
反应③ | A(g)= D(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快D.则增大压强,K1减小,K2增大,K3不变