题目内容
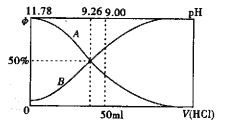
【题目】25℃时,用NaOH溶液滴定H2C2O4 溶液,溶液中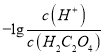 和-lgc(HC2O4-)或
和-lgc(HC2O4-)或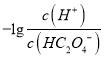 和-lgc(C2O42-)关系如图所示,下列说法正确的是
和-lgc(C2O42-)关系如图所示,下列说法正确的是
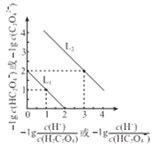
A. 曲线L1表示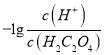 和-lgc(HC2O4-)的关系
和-lgc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.1mol/LH2C2O4溶液中加入少量水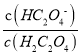 减小
减小
【答案】A
【解析】A. H2C2O4是二元弱酸,在溶液中发生两步电离:H2C2O4 ![]() HC2O4-+H+、HC2O4-
HC2O4-+H+、HC2O4-![]() C2O42-+H+,Ka1=
C2O42-+H+,Ka1=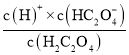 、Ka2=
、Ka2= ,-lgKa1=-lg
,-lgKa1=-lg =-[lg
=-[lg +lgc(HC2O4-)]、-lgKa2=-lg
+lgc(HC2O4-)]、-lgKa2=-lg =-[lg
=-[lg +lgc(C2O42-)],因Ka1>Ka2,则-lgKa1<-lgKa2,即-[lg
+lgc(C2O42-)],因Ka1>Ka2,则-lgKa1<-lgKa2,即-[lg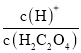 +lgc(HC2O4-)]<-[lg
+lgc(HC2O4-)]<-[lg +lgc(C2O42-)],所以曲线L1表示
+lgc(C2O42-)],所以曲线L1表示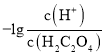 和-lgc(HC2O4-)的关系,故A正确;B. 曲线L2表示
和-lgc(HC2O4-)的关系,故A正确;B. 曲线L2表示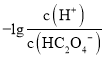 和-lgc(C2O42-)的关系,据图可知,-lgKa2=-lg
和-lgc(C2O42-)的关系,据图可知,-lgKa2=-lg =-[lg
=-[lg +lgc(C2O42-)]=2+3=5,则Ka2=10-5,Ka2(H2C2O4)的数量级为10-5,故B错误;C. 由上述分析可知,HC2O4-发生电离的平衡常数Ka2=10-5,HC2O4-发生水解反应的平衡常数Kh=
+lgc(C2O42-)]=2+3=5,则Ka2=10-5,Ka2(H2C2O4)的数量级为10-5,故B错误;C. 由上述分析可知,HC2O4-发生电离的平衡常数Ka2=10-5,HC2O4-发生水解反应的平衡常数Kh=![]() =
=![]() =10-12,Ka2>Kh,即HC2O4-的电离程度大于水解程度,所以在NaHC2O4溶液中c(Na+)>c(HC2O4-)> c(C2O42-) >c(HC2O4),故C错误;D. 由Ka1=
=10-12,Ka2>Kh,即HC2O4-的电离程度大于水解程度,所以在NaHC2O4溶液中c(Na+)>c(HC2O4-)> c(C2O42-) >c(HC2O4),故C错误;D. 由Ka1=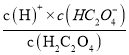 可得:
可得: 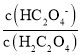 =
=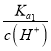 ,向0.1mol /LH2C2O4溶液中加入少量水,Ka1不变,c(H+)减小,则
,向0.1mol /LH2C2O4溶液中加入少量水,Ka1不变,c(H+)减小,则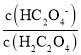 =
=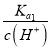 增大,故D错误;答案选A。
增大,故D错误;答案选A。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案