题目内容
【题目】研究称癌症导致的死亡率呈逐年上升的趋势,目前是仅次于心血管疾病的第二大杀手。M是一种可用于治疗肿瘤的药物,其合成路线如下

已知:①芳香烃A的相对分子质量在86-96之间:F能使溴水褪色。
②J与 NaHCO3溶液反应放出CO2气体,核磁共振氢谱显示其有3个吸收峰。
③ ④M的结构简式为
④M的结构简式为
回答下列问题:
(1)A的化学名称为________________ , ④的反应类型是_____________.
(2)D分子中所含官能团的名称为_________________________。
(3)②的反应方程式为________________,⑤的反应方程式为__________________。
(4)N(C7H7NO2)是E在一定条件下的水解产物,符合下列条件的N的同分异构体有_____种。其中核磁共振氢谱有4个峰的结构简式为_________________。
①分子中苯环上直接连一NH2②能发生银镜反应
(5)4-甲氧基乙酰苯胺( )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )和乙酰氯( CH3 COCl)制备4-甲氧基乙酰苯胺的合成路线(无机试剂任选):_____________________________________________________________。
)和乙酰氯( CH3 COCl)制备4-甲氧基乙酰苯胺的合成路线(无机试剂任选):_____________________________________________________________。
【答案】 甲苯 取代反应(或:水解反应) 氟原子、硝基 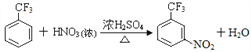 2(CH3)2CHCH2OH+O2
2(CH3)2CHCH2OH+O2 ![]() 2(CH3)2CHCHO+2H2O 13
2(CH3)2CHCHO+2H2O 13 ![]()

【解析】根据题给信息可知根据有机物C结构简式可知,B为C6H5CH2Cl, A C6H5CH3,分子量为92,在86-96之间;D的结构中-NO2和-CF3位于苯环的间位。J与 NaHCO3溶液反应放出CO2气体,含有羧基,核磁共振氢谱显示其有3个吸收峰,其结构简式为CH3-CH(CH3)-COOH,I为 CH3-CH(CH3)-CHO, H为CH3-CH(CH3)-CH2OH, G为 CH3-CH(CH3)-CH2Br,F为 CH3-C(CH3)=CH2;F能使溴水褪色。
(1)综上所述,A的化学名称为甲苯,溴代烃在氢氧化钠溶液中发生取代反应生成醇,正确答案:甲苯 ;取代反应(或:水解反应)。
(2)D为芳香族化合物,D的结构中-NO2和-CF3位于苯环的间位,官能团的名称为氟原子、硝基;正确答案:氟原子、硝基。
(3)有机物C在浓硫酸、浓硝酸作用下发生苯环上硝化反应,反应方程式为: ;有机物CH3-CH(CH3)-CH2OH在铜作催化剂情况下,被氧化为醛,的反应方程式为2(CH3)2CHCH2OH+O2
;有机物CH3-CH(CH3)-CH2OH在铜作催化剂情况下,被氧化为醛,的反应方程式为2(CH3)2CHCH2OH+O2 ![]() 2(CH3)2CHCHO+2H2O ;正确答案:
2(CH3)2CHCHO+2H2O ;正确答案: ;2(CH3)2CHCH2OH+O2
;2(CH3)2CHCH2OH+O2 ![]() 2(CH3)2CHCHO+2H2O。
2(CH3)2CHCHO+2H2O。
(4)符合条件①分子中苯环上直接连一NH2②能发生银镜反应;1个HCOO- 和一NH2分别连在苯环上,有机物有3种(邻、间、对);1个-CHO、1个-OH、1个一NH2分别连在苯环上有10种,共有13种;其中核磁共振氢谱有4个峰的结构简式为![]() ;正确答案:13;
;正确答案:13;![]() 。
。
(5)![]() 在浓硝酸、浓硫酸加热情况下发生硝化反应,生成含有硝基的化合物,在铁、盐酸作用下,硝基还原为氨基,最后与CH3COCl/吡啶发生取代反应,得到产物;整个流程如下:
在浓硝酸、浓硫酸加热情况下发生硝化反应,生成含有硝基的化合物,在铁、盐酸作用下,硝基还原为氨基,最后与CH3COCl/吡啶发生取代反应,得到产物;整个流程如下:
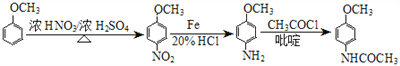 ;正确答案:
;正确答案: 。
。

 名校课堂系列答案
名校课堂系列答案