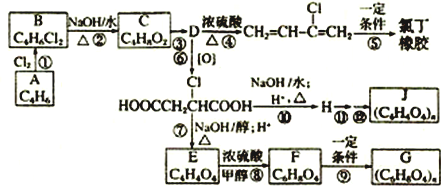
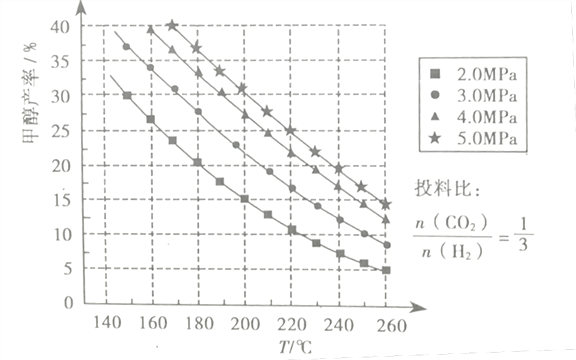
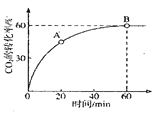
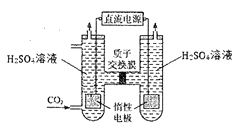
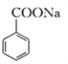
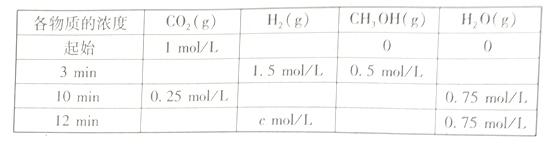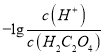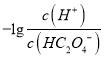题目内容
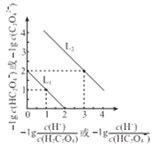
【题目】25℃时,用0.10m/L的弱碱BOH滴定10.00 ml a mol/L的盐酸,溶液的pH与所加BOH溶液体积(V)的关系如图所示。已知N点溶液中存在关系式:c(C1—)=c(B+)+c(BOH)。下列说法正确的是

A. M点溶液中存在c(H+)=c(OH—)+2c(BOH)+c(B+)
B. N、Q两点溶液中BOH电离平衡常数:N<Q
C. P点BOH过量,此时溶液中c(B+)>c(Cl—)
D. a<0.108
【答案】A
【解析】根据N点溶液中存在关系式:c(C1—)=c(B+)+c(BOH),可知,弱碱BOH与盐酸恰好完全反应生成BCl,当弱碱BOH的体积为5.40 mL时,所得溶液的溶质为HCl和 BCl (1:1),根据电荷守恒:c(H+)+ c(B+)=c(OH—)+ c(C1—) ;物料守恒:2c(BOH)+2c(B+)= c(C1—),两个式子消去c(C1—),得c(H+)=c(OH—)+2c(BOH)+c(B+),A正确;温度不变,电离平衡常数不变,N、Q两点溶液中BOH电离平衡常数:N=Q,B错误;P点时溶液为中性,c(H+)= c(OH—),所以电荷守恒:c(B+)+ c(H+)= c(OH—)+ c(Cl—),c(B+)=c(Cl—),C错误;若a<0.108,在N点溶液时,弱碱与盐酸不会恰好完全反应生成BCl,不会满足c(C1—)=c(B+)+c(BOH),只能是a=0.108,D错误;正确选项A。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目