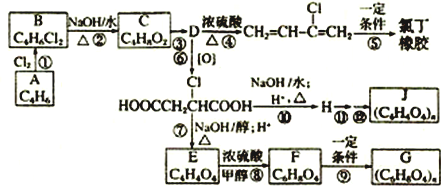
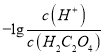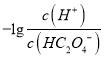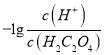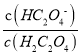题目内容
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
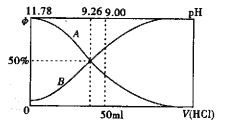
①表示NH3·H2O浓度变化的曲线是______(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L(用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH调整为3,则溶液中Al3+浓度为_____mol/L。
【答案】 B A 1.8×10-5或10-4.74 10-5-10-9 Al3++3HCO3-=Al (OH)3↓+3CO2↑ 4.0×10-5
【解析】本题主要考查有溶液中的离子平衡。
I.(1)A.正反应速率减小,故A不符合题意;B. 正反应速率增大,且平衡右移使平衡混合物中NH3的体积分数,故B符合题意;C. 平衡混合物中NH3的体积分数减小,故C不符合题意;D. 平衡混合物中NH3的体积分数减小,故D不符合题意。故选B。
(2)①反应过程中氨水的pH减小,所以表示NH3·H2O浓度变化的曲线是A。
②NH3·H2O的电离常数为Kb=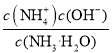 =
=![]() =1.8×10-5。
=1.8×10-5。
③当加入盐酸体积为50ml时,中和反应恰好完全进行,形成氯化铵溶液,溶液中 c(H+)=c(OH-)+c(NH3·H2O),所以c(NH4+)-c(NH3·H2O)= c(H+)-c(OH-)=(2×10-5-2×10-9)mol/L。
II.在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为Al3++3HCO3-=Al (OH)3↓+3CO2↑;若将所得悬浊液的pH调整为3,c(OH-) =![]() =
=![]() mol/L=1×10-2mol/L,则溶液中Al3+浓度为
mol/L=1×10-2mol/L,则溶液中Al3+浓度为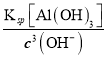 =4.0×10-5mol/L。
=4.0×10-5mol/L。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案