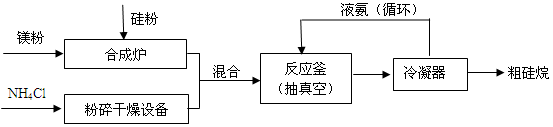
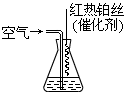
题目内容
化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握一项基本技能。请按照要求完成下列方程式。
Ⅰ.生活中很多现象和原理都可以用化学反应来解释:写出 泡沫灭火器反应原理 的离子方程式:
________________________________________________________________________
Ⅱ.某一反应体系有反应物和生成物共六种物质:N2O.FeSO4.Fe(NO3)3.HNO3.Fe2(SO4)3和H2O。写出该反应的化学方程式:
________________________________________________________________________
Ⅲ.有一些反应,表面上似乎违背了反应的基本原理,事实上他们是完全符合反应基本原理的。请完成下列反应:
① 写出 两种弱酸溶液混合反应后,溶液的酸性减弱 的化学方程式
________________________________________________________________________
② 写出 一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸 的离子反应方程式
Ⅰ.Al3++3HCO3-=Al(OH)3↓+3CO2↑;
Ⅱ.24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O;
Ⅲ.① 2H2S+H2SO3=3S↓+3H2O
②Cu2++H2S=CuS↓+2H+
解析试题分析:Ⅰ.(1)泡沫灭火器反应原理是硫酸铝和碳酸氢钠溶液混合产生二氧化碳和氢氧化铝沉淀,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;Ⅱ.一反应体系有反应物和生成物共六种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O,硝酸做氧化剂被还原为N2O,能做还原剂的化合价升高,FeSO4被氧化为硫酸铁、硝酸铁,依据氧化还原反应的电子守恒和反应的原子守恒书写配平化学方程式:24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O;Ⅲ①两种弱酸溶液混合反应后,溶液的酸性减弱,依据所学弱酸混合发生氧化还原反应:还原性酸为H2S,氧化性弱酸为H2SO3;化学方程式为:2H2S+H2SO3=3S↓+3H2O;②一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸,依据复分解反应条件分析:硫酸铜和氢硫酸反应生成硫化铜沉淀,难溶于强酸,反应的离子方程式为Cu2++H2S=CuS↓+2H+。
考点:本题考查了泡沫灭火器的反应原理,实验室制氨气的原理,氧化还原反应的化合价升降,电子守恒的应用,常见物质性质的反应应用,主要是化学方程式.离子方程式的书写。

已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
 丙。则:
丙。则:①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为
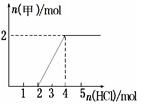
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。
下列结论正确的是 ( )
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
| A.①④⑤ | B.③⑥ | C.②④⑤⑥ | D.①③④ |
在元素周期表中,同主族元素的原子具有相同的 ( )
| A.最外层电子数 | B.核电荷数 | C.电子层数 | D.核外电子数 |
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2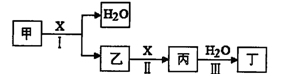
 丙(g) + H2(g),得到如下数据:
丙(g) + H2(g),得到如下数据: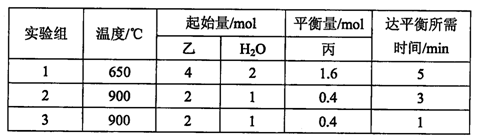

 Si3N4+12H2
Si3N4+12H2 4NH3↑+SiH4↑+2MgCl2(△H < 0)
4NH3↑+SiH4↑+2MgCl2(△H < 0)