题目内容
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2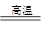 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所选试剂为 。证明炉渣中含有FeO的实验现象为 。
(1)Cu、O(少写,错写不计分)
(2)b、c(少写,错写不计分)
(3)a:Al3++4OH-=AlO2-+2H2O(若分2步写,只有均配平,也得2分;只写生成Al(OH)3不得分)
b:稀硫酸、KMnO4溶液(其他合理答案也可以) 稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
解析试题分析:(1)化合价降低的元素就是反应中被还原的元素所以是Cu、O。
(2)处理SO2方案合理的是b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3进行了回收利用,变废为宝。
(3)a.除去Al3+的要加过量的碱溶液故离子方程式是Al3++4OH-=AlO2-+2H2O。b.选先取试剂加入稀硫酸溶液溶解再加入KMnO4溶液若褪色可证明。
考点:本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度较大.

 阅读快车系列答案
阅读快车系列答案下列各组原子序数表示的两种元素中,能够形成共价化合物的是
| A.11与17 | B.11与10 | C.1与17 | D.1与8 |
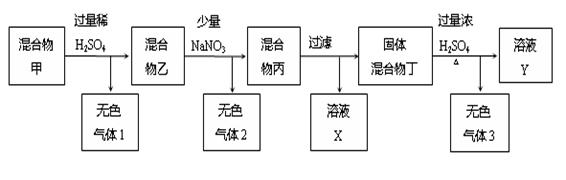
 、X中的一种。
、X中的一种。 C.CH3COO D.SiO
C.CH3COO D.SiO