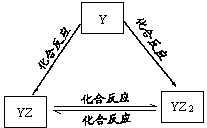
题目内容
氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
3 SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
(1)以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2(△H < 0)
4NH3↑+SiH4↑+2MgCl2(△H < 0)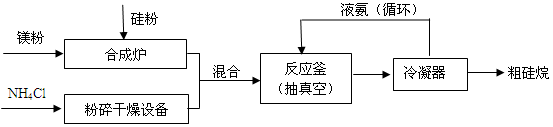
①NH4Cl的化学键类型有____________,SiH4电子式为_______________。
②上述生产硅烷的过程中液氨的作用是________________________。
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______,实验室可利用如图所示装置完成该反应。 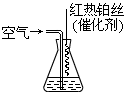
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是_____________。
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________________________。将0.184 g三硅酸镁加到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8?nH2O的n值为_________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
(14分)
(1)①极性键(或共价键)、离子键 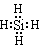
②吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可)
③4NH3+5O2 4NO+6H2O NH4NO3(或:硝酸铵)
4NO+6H2O NH4NO3(或:硝酸铵)
(2)Mg2Si3O8?nH2O + 4HCl = 3H2SiO3 + 2MgCl2 + (n-1)H2O 6
解析试题分析:
(1)③4NH3+5O2 4NO+6H2O 2NO+ O2 ="2N" O2 3N O2+ H2O= 2HNO3+ NO
4NO+6H2O 2NO+ O2 ="2N" O2 3N O2+ H2O= 2HNO3+ NO
NH3+ HNO3 = NH4NO3 (白烟) 设Mg2Si3O8?nH2O的物质的量为x
(2)HCl + NaOH="NaCl+" H2O Mg2Si3O8?nH2O + 4HCl = 3H2SiO3 + 2MgCl2 + (n-1)H2O
30*0.1*10-3 30*0.1*10-3 1 4
x 50*0.1*10-3 -30*0.1*10-3
x=5*0.1*10-3
M Mg2Si3O8?nH2O="m/n=0.184" g/5*0.1*10-3=368(g/mol) n=(368-260)/18=6
考点:本题以化工生产为基础,考查物质结构、元素化合物性质、化学计算等知识。

 金博士一点全通系列答案
金博士一点全通系列答案工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下: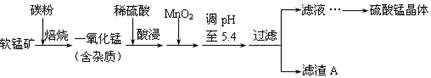
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
同一主族的两种元素的原子序数之差不可能的是
| A.16 | B.26 | C.36 | D.46 |
下列关系中,正确的是
| A.原子半径:Mg>K | B.非金属性:O<S |
| C.稳定性:HCl>HBr | D.碱性:NaOH>KOH |
 、X中的一种。
、X中的一种。 C.CH3COO D.SiO
C.CH3COO D.SiO