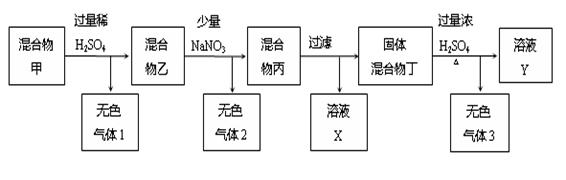
题目内容
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙
 丙。则:
丙。则:①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为
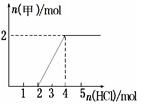
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。
Ⅰ.①FeCl3+3H2O Fe(OH)3↓+3HCl↑(2分)
Fe(OH)3↓+3HCl↑(2分)
②第三周期,第ⅢA族(2分); B D (2分,少选1分,错选不得分)
③Al-3e-+4OH-=AlO2-+2H2O (3分)
Ⅱ.①CO2+C 2CO (2分); ②0.5NA或3.01×1023(2分)
2CO (2分); ②0.5NA或3.01×1023(2分)
③c (Na+) > c(CO32-) > c(OH-) >c(HCO3-)>c(H+)(3分)
解析试题分析:Ⅰ.①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,则甲发生a反应的化学方程式为:FeCl3+3H2O Fe(OH)3↓+3HCl↑
Fe(OH)3↓+3HCl↑
②若甲为某短周期金属元素的氯化物,则该金属为Al,在元素周期表中位于:第三周期,第ⅢA族;30 mL 1 mol/L的甲的溶液含AlCl30.03mol,逐渐加入浓度为4 mol/L的NaOH溶液,产生0.78 g白色沉淀,为0.01mol的Al(OH)3,可能为AlCl3与NaOH直接反应生成0.01molAl(OH)3,Al3++3OH?=Al(OH)3↓加入的NaOH溶液的体积为:0.01mol×3÷4mol?L?1=0.0075L=7.5mL,也可能为AlCl3与NaOH全部反应转化为Al(OH)3,继续滴加NaOH溶液,溶解部分Al(OH)3,剩余的Al(OH)3为0.01mol,Al3++3OH?=Al(OH)3↓需要NaOH为3n(Al3+)=0.03mol×3=0.09mol,Al(OH)3+OH? ==AlO2-+2H2O,需要NaOH为0.03mol-0.01mol=0.02mol,共需要NaOH溶液:(0.09mol+0.02mol)÷4mol?L?1=0.0275L=27.5mL,故BD项。
③由于在碱性溶液中,只有铝能失电子发生反应,所以Al为负极,失去电子转化为AlO2-,所以负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。
Ⅱ.①甲、乙、丙为短周期元素,乙为固体单质,甲丙为气体,甲、乙高温下生成丙,且三者均位于同一周期,只可能为C、N、O三元素组成的化合物,综合分析可知:甲为CO2,乙为碳,丙为CO,所以该反应的化学方程式为:CO2+C 2CO。
2CO。
②气体甲与足量的过氧化钠反应为:2CO2+2Na2O2=2Na2CO3+O2,根据化合价的变化可得:CO2 ~ e?,所以0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为0.5NA或3.01×1023。
③根据n(HCl)与生成n(甲)的关系图,两段需要的HCl相等,说明溶液A的溶质为Na2CO3,故各离子浓度由大到小的顺序为:c (Na+) > c(CO32-) > c(OH-) >c(HCO3-)>c(H+)
考点:本题考查元素化合物的推断、方程式的书写、根据化学方程式的计算、原电池原理、电子转移、离子浓度比较。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案下列陈述I、II正确且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾溶液褪色 |
| B | 硫酸铜是强酸弱碱盐 | 蒸干CuSO4溶液可以得到Cu(OH)2固体 |
| C | SO2是酸性氧化物 | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| D | 氢氧化铝显两性 | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaOH溶液,沉淀消失 |
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: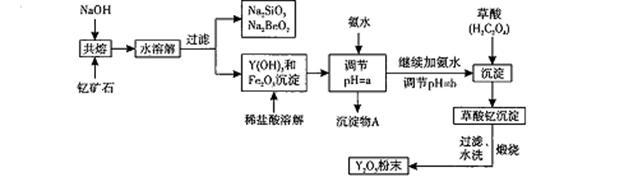
已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、 (填字母代号)两种试剂,再通过必要的实验操作方可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: :必要的实验操作应是 。
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在 的范围内;继续加氨
水调节pH =b发生反应的离子方程式为 ,溶液中Fe3+完全沉淀的判定标准是 。
(4)写出草酸钇[Y2(C2O4)3.Nh2O]煅烧的化学方程式 。
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下: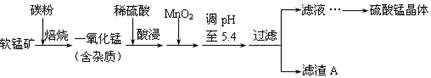
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。