题目内容
5.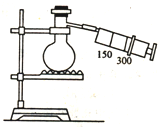 如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答:
如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答:(1)欲提高铜与稀HNO3的反应速率,可采取多种不同的措施.若采用加入化学试剂的方法,可加入C(填字母代号).
A.水 B.碳酸钠 C.少量的浓HNO3若添加仪器,图中还缺少一种仪器的名称是酒精灯.
(2)橡皮塞用锡箔包住的原因是浓硝酸具有强的氧化性能够使橡胶老化.
(3)反应开始时,烧瓶中可观察到的主要现象有①溶液变蓝;②生成无色气体,随之变成红棕色气体;③注射器活塞慢慢外移.
(4)停止反应后,轻轻反复推拉注射器活塞,使气体与气体,气体与液体皆充分反应.若忽略液体体积的变化,最终溶液中c(NO3-)与开始时相比C(填字母代号).
A.变小B.变大C.不变 D.无法确定.
分析 (1)依据提高反应速率方法:增大反应物浓度、升高温度、增大基础面积等;
(2)浓硝酸具有强的氧化性,能够使橡胶老化;
(3)铜与稀硝酸发生反应:3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO↑,一氧化氮与氧气反应生成二氧化氮,二氧化氮物红棕色,依据装置内气体多少判断注射器活塞移动情况;
(4)待Cu与HNO3反应停止后,此时装置内NO2的体积为89.6mL,过量氧气略大于60.2mL.若再通过轻轻推拉注射器活塞,使装置内气体与气体、气体与液体之间充分反应,则又发生反应:4NO2+O2+2H2O=4HNO3,O2过量;NO2又全部转化为HNO3.显然,若忽略液体体积的变化,最终溶液中NO3-的物质的量浓度与开始时的浓度相等.
解答 解:(1)A.加入水硝酸的浓度进一步降低,反应速率降低,故不选;
B.碳酸钠能够与硝酸反应消耗硝酸,反应速率降低,故不选;
C.加入少量的浓HNO3,增大硝酸浓度,反应速率加快,故选;
若用升高温度的方法,必须提供热源,使用酒精灯;
故答案为:C;酒精灯;
(2)硝酸具有强的氧化性,能够使橡胶老化,为防止橡胶老化,橡皮塞用锡箔包住;
故答案为:硝酸具有强的氧化性,能够使橡胶老化;
(3)参加反应的Cu和HNO3的物质的量分别为0.006mol和0.045mol,实验装置内的氧气体积约占500×21%→105(mL),若加上注射器内所含的氧气,其氧气的总体积应略大于105mL.当烧瓶中的Cu和HNO3反应开始后:
3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO↑
3mol 8mol 44800mL
0.006mol 0.045mol 89.6mL
因为0.006/$\frac{0.006}{3}$<$\frac{0.045}{8}$,所以HNO3过量,Cu全部氧化而溶解,溶液变蓝色(水合铜离子的颜色).通过分析上述反应可知:每当3mol Cu被氧化,必同时有2mol HNO3被还原.所以,当有0.006mol Cu被氧化,则被还原的HNO3的物质的量应为0.004mol,同时生成89.6mL无色气体NO(标况).在上述反应中,共消耗HNO3 0.016mol,还剩余HNO3 0.029mol.
由于装置内O2的存在,随之发生反应:
2NO+O2 =2NO2
89.6mL 44.8mL 89.6mL
所以,此时装置内气体的体积增加89.6-44.8=44.8(mL),由于气体的体积增大,装置内压强随之增大,注射活塞慢慢外移;
故答案为:①溶液变蓝;②生成无色气体,随之变成红棕色气体;③注射器活塞慢慢外移;
(4)待Cu与HNO3反应停止后,此时装置内NO2的体积为89.6mL,过量氧气略大于60.2mL.若再通过轻轻推拉注射器活塞,使装置内气体与气体、气体与液体之间充分反应,则又发生反应:4NO2+O2+2H2O=4HNO3,O2过量;NO2又全部转化为HNO3.显然,若忽略液体体积的变化,最终溶液中NO3-的物质的量浓度与开始时的浓度相等;
故答案为:C.
点评 本题考查了硝酸的性质及影响反应速率因素,熟悉硝酸的强的氧化性是解题关键,题目难度中等.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 苯的分子式C6H6 | D. | 四氯化碳的电子式 |
| A. | 往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 | |
| B. | 物质的量浓度均为0.1mol•Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)<c(CH3COOˉ) | |
| C. | 某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)>c(OHˉ) | |
| D. | 在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Clˉ)+c(OHˉ) |
| A. | NaOH是离子化合物不含共价键 | B. | CO2分子中含有非极性键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
| A. | Na、Mg、Al还原性依次减弱 | |
| B. | F2、Cl2、Br2、I2单质的氧化性依次减弱 | |
| C. | C、N、O原子半径依次增大 | |
| D. | P、S、Cl最高正价依次升高 |
 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl. 某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下: