题目内容
16.一定质量的某金属${\;}_{Z}^{A}$X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个 ${\;}_{Z}^{A}$Xn+,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子.(1)求Z、n和A的值.(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式.
分析 (1)根据n=$\frac{N}{NA}$计算离子的物质的量,由电子和离子的物质的量之比求出电荷数;根据离子个数与质子数、中子数之比求出质子数、质量数.
(2)根据反应物和生成物写出相应的反应方程式.
解答 解:(1)根据n=$\frac{N}{NA}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,离子和电子的物质的量之比为0.1mol:0.3mol=1:3,物质的量之比等于微粒个数之比,所以一个离子是由该原子失去三个电子生成的,故电荷数为3;离子数与质子数、中子数之比为=6.02×1022个:6.02×1.3×1023个:6.02×1.4×1023个=1:13:14,所以该离子中含有13个质子、14个中子,故A为27,Z=A-N=27-14=13;
答:Z、n和A的值分别为:13、3、27;
(2)通过(1)知,该元素是Al,铝与NaOH溶液反应生成偏铝酸钠和氢气,所以化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
答:该金属与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
点评 本题考查了有关阿伏伽德罗常数的计算和化学反应方程式的书写,难度不大,明确物质的量之比等于微粒个数之比是解本题的关键.

练习册系列答案
相关题目
7.下列微粒间的作用力中,不属于化学键的是( )
| A. | 分子间作用力 | B. | 金属键 | C. | 共价键 | D. | 离子键 |
5.已知X元素的某种同位素的氯化物XCln为离子化合物,在该化合物中X元素的微粒的核内中子数为m,核外电子数为y,则该同位素的符号是( )
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |

 (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑ ;化合物BA4的电子式为
;化合物BA4的电子式为 .
. .
.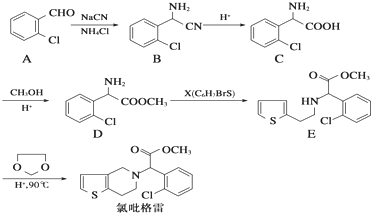 ,
, .
.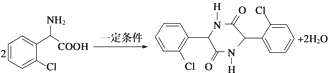 .
.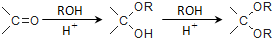 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物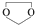 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物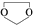 的最后一步反应
的最后一步反应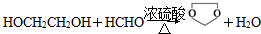 .
.