题目内容
20.下列仪器的使用或操作正确的是( )| A. | 分液漏斗中液体的总体积不得超过其容量的2/3 | |
| B. | 萃取时,用右手压住分液漏斗的玻璃塞,左手握住旋塞,将分液漏斗倒过来用力震荡 | |
| C. | 分液漏斗的检漏只需检查旋塞处是否漏水即可 | |
| D. | 课本中测定中和热实验的装置,用铜制环形搅棒代替玻璃环形搅棒更耐用 |
分析 A.分液漏斗中液体体积不能超出容器容积的三分之二;
B.分液时用右手压住分液漏斗口部,左手握住活塞部分,将分液漏斗倒过来用力震荡;
C.分液漏斗带有玻璃塞和活塞,用来分离互不相溶的液体,使用前必须应检漏;
D.铜制搅拌棒导热性强.
解答 解:A.装液时,分液漏半中液体的总体积不得超过其容器的三分之二,若过多,不能充分萃取,故A正确;
B.分液时用右手压住分液漏斗口部,左手握住活塞部分,将分液漏斗倒过来用力震荡.故B正确;
C.分液漏斗带有带有玻璃塞和活塞,用来分离互不相溶的液体,使用前必须应检漏,检查塞处和瓶口处,故C错误;
D.铜制搅拌棒导热性强,中和热测定实验不能用铜制搅拌棒代替玻璃环形搅拌棒,故D错误;
故选AB.
点评 本题考查了分液漏斗的使用及注意事项、中和热的测定,题目难度不大,注意仪器的使用.

练习册系列答案
相关题目
10.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作光导纤维 | ||
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
15.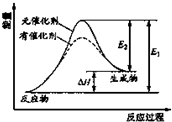 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
5.已知X元素的某种同位素的氯化物XCln为离子化合物,在该化合物中X元素的微粒的核内中子数为m,核外电子数为y,则该同位素的符号是( )
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |
12.下列各组有机物,无论以何种比例混合,只要二者的物质的量之和不变,那么完全燃烧时所消耗的氧气的物质的量相等,且所生成的水的物质的量也相等的是( )
| A. | 甲烷和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯酚 | D. | 乙炔和苯 |
9.能正确表示下列化学反应的离子方程式是( )
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
10.下列各组离子,能在溶液中大量共存的是( )
| A. | NH4+、Na+、OH-、SO42- | B. | NH4+、Mg2+、NO3-、Cl- | ||
| C. | Ba2+、OH-、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
 (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑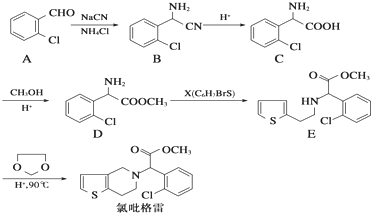 ,
, .
.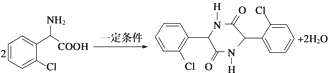 .
.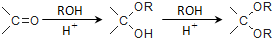 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物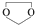 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物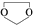 的最后一步反应
的最后一步反应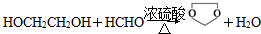 .
.