题目内容
1.配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时,在天平托盘上放上称量纸,将NaOH固体放在纸上称量 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A、转移溶液后未洗涤烧杯和玻璃棒就直接定容,会导致溶质的损失,则浓度偏低,故A错误;
B、氢氧化钠固体易潮解,放在纸上称量时吸潮后,会导致氢氧化钠的实际质量偏小,故所配溶液的浓度偏低,故B错误;
C、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故C正确;
D、摇匀时,液面低于刻度线是正常的,若再加水至刻度线,则会导致浓度偏低,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
3.粒子甲与粒子乙在溶液中的转化关系如图所示,粒子甲不可能是( )


| A. | NH4+ | B. | Al2O3 | C. | HCO3- | D. | SO2 |
8.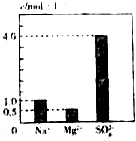 0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )
0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )
 0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )
0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )| A. | 该溶液中NaSO4的物质的量浓度为1.0mol•L-1 | |
| B. | 该溶液中MgSO4的物质的量为0.25mol | |
| C. | 该溶液中MgSO4的质量为30g | |
| D. | 该溶液中Al2(SO4)3的物质的量浓度为1.0mol•L-1 |
10.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.已知反应Fe2O3+K2O${\;}_{{\;}_{2}}$→K2FeO4+K2O(未配平),下列说法正确的是( )
| A. | K2O2既是氧化剂又是还原剂 | |
| B. | K2FeO4的氧化性强于K2O2 | |
| C. | 16gFe2O3发生反应,有0.3mole-转移 | |
| D. | 用K2FeO4处理水时有Fe(OH)3胶体生成 |
11.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•L-1Mg(NO3)2溶液中含有0.2 NA个NO3- | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 3mol Cu和足量稀硝酸反应产生2 NA个NO分子 | |
| D. | 1 mol Cl2与足量NaOH溶液反应,转移电子数为NA |
 .
.