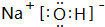题目内容
6.现需要物质的量浓度为1.0mol•L-1的NaOH溶液480mL.回答下列问题:(1)实验室要配制此溶液,需要称量的NaOH固体的质量为20.0g.
(2)实验过程中可供选择的仪器有:①③⑥⑦⑧⑨.
①玻璃棒;②烧瓶;③烧杯;④滤纸;⑤480mL容量瓶 ⑥托盘天平;⑦药匙 ⑧胶头滴管⑨500mL容量瓶
(3)将所配制的NaOH溶液进行测定,发现浓度小于1.0mol•L-1.请你分析配制过程中可能引起误差偏小的原因BD.
A.定容时俯视刻度线B.转移时没有洗涤烧杯和玻璃棒
C.配制时容量瓶没有干燥 D.称量NaOH时可能砝码残缺
(4)配制好的NaOH溶液不能用带磨口玻璃塞的试剂瓶保存,请解释原因(用化学方程式表示并且配有简单的文字叙述)二氧化硅能和氢氧化钠反应2NaOH+SiO2=Na2SiO3+H2O,生成的Na2SiO3溶液具有粘性,可以把试剂瓶和瓶盖粘住,不易打开.
分析 (1)根据n=cV和m=nM来计算;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)玻璃中含二氧化硅,是一种酸性氧化物.
解答 解:(1)由于实验室无480mL的容量瓶,故应选择500mL的容量瓶,配置出500mL的1.0mol/L的氢氧化钠溶液,所需的质量m=CVM=1mol/L×0.5L×40g/mol=20.0g,故答案为;20.0g;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有:①玻璃棒;③烧杯; ⑥托盘天平;⑦药匙 ⑧胶头滴管⑨500mL容量瓶,故答案为:①③⑥⑦⑧⑨;
(3)A.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故A不选;
B.转移时没有洗涤烧杯和玻璃棒,会导致溶质的损失,浓度偏低,故B选;
C. 若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C不选;
D.称量NaOH时砝码残缺,会导致所称量出的额氢氧化钠固体的质量偏小,则浓度偏低,故D选.
故选BD.
(4)玻璃中含二氧化硅,是一种酸性氧化物,能和氢氧化钠反应:2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3溶液具有粘性,可以把试剂瓶和瓶盖粘住,不易打开.故答案为:二氧化硅能和氢氧化钠反应2NaOH+SiO2=Na2SiO3+H2O,生成的Na2SiO3溶液具有粘性,可以把试剂瓶和瓶盖粘住,不易打开.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
8.下列各组物质属于同系物的是( )
| A. | H2和D2 | B. | 苯和甲苯 | C. | 正丁烷和异丁烷 | D. | 葡萄糖和果糖 |
9.下列说法正确的是( )
| A. | 若反应物键能之和大于生成物键能之和,则该反应为放热反应 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 因为水分子内存在氢键,所以水的沸点比硫化氢的沸点高 | |
| D. | 需要加热才能发生的化学反应不一定是吸热反应 |
1.配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时,在天平托盘上放上称量纸,将NaOH固体放在纸上称量 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
11.现有稀梳酸和稀硝酸的混合溶液,已知稀硝酸浓度2mo/L,取10mL混合酸,加入过量铁粉,生成标准状况下的气体672mL(假设HNO3,只被还原为NO,反应结束后溶液体积不变),则溶液中阳离子浓度为( )
| A. | 3mo/L | B. | 1.5mo/L | C. | 2mo/L | D. | 4mo/L |
18.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 在标准状况下,22.4L氦气所含的原子数约为2NA | |
| C. | 同温同压下,等体积的硫酸和硝酸所含氢原子数之比为2:1 | |
| D. | 1molCxHy分子中所含C-H数目为yNA |
16.实验室保存下列试剂的方法有错误的是( )
| A. | 新制氯气盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 固体碘常盛放在棕色细口瓶中 | |
| C. | 液溴易挥发,盛放在用水液封的棕色试剂瓶中 | |
| D. | 金属钠易被氧化,少量金属钠应储存在煤油中 |