题目内容
8.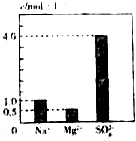 0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )
0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )| A. | 该溶液中NaSO4的物质的量浓度为1.0mol•L-1 | |
| B. | 该溶液中MgSO4的物质的量为0.25mol | |
| C. | 该溶液中MgSO4的质量为30g | |
| D. | 该溶液中Al2(SO4)3的物质的量浓度为1.0mol•L-1 |
分析 由图可知Na+、Mg2+和SO42-的浓度分别为:1.0mol/L、0.5mol/L和4.0mol/L,根据电荷守恒c(Na+)+2c(Mg2+)+3c(Al3+)=2c(SO42-),所以c(Al3+)=$\frac{1}{3}$[2c(SO42-)-c(Na+)-2c(Mg2+)]=$\frac{1}{3}$×(2×4-1-0.5×2)=2mol/L,所以溶质为:0.50mol/LNa2SO4、0.50mol/LMgSO4、1.0mol•L-1Al2(SO4)3,由此分析解答.
解答 解:由图可知Na+、Mg2+和SO42-的浓度分别为:1.0mol/L、0.5mol/L和4.0mol/L,根据电荷守恒c(Na+)+2c(Mg2+)+3c(Al3+)=2c(SO42-),所以c(Al3+)=$\frac{1}{3}$[2c(SO42-)-c(Na+)-2c(Mg2+)]=$\frac{1}{3}$×(2×4-1-0.5×2)=2mol/L,所以溶质为:0.50mol/LNa2SO4、0.50mol/LMgSO4、1.0mol•L-1Al2(SO4)3,
A、该溶液中Na2SO4的物质的量浓度为0.50mol•L-1,故A错误;
B、该溶液中MgSO4的物质的量为:0.50mol/L×0.5L=0.25mol,故B正确;
C、所以质量为:0.25mol×120g/mol=30g,故C正确;
D、该溶液中Al2(SO4)3的物质的量浓度为1.0mol•L-1,故D正确;
故选A.
点评 本题是一道有关溶质组成的综合知识题目,学生首先要学会识图,然后根据电荷守恒求解,考查角度很广,难度较大.

练习册系列答案
相关题目
18.水的电离平衡曲线如如图所示,下列说法不正确的是( )
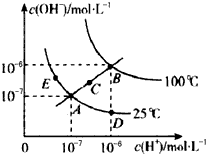

| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | 若从A点到D点,可采用在水中加入少量酸的方法 | |
| C. | 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体 | |
| D. | 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性 |
19.下列离子方程式中,书写正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| B. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 用FeCl3溶液腐蚀电路板上多余的铜:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 碳酸氢钠溶液与稀盐酸反应:CO32-+2H+═CO2↑+H2O |
16.下列说法正确的是( )
| A. | SO2有还原性,可被浓硫酸氧化 | |
| B. | NH3有还原性,可与浓硫酸发生氧化还原反应 | |
| C. | 在Cu和浓HNO3的反应中,参加反应的HNO3有$\frac{1}{2}$被还原 | |
| D. | 将胆矾加入浓H2SO4中,胆矾变白,这是浓硫酸的脱水性 |
3.将一块银白色的金属钠放在空气中会发生一系列的变化,表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述正确的是( )
| A. | 表面迅速变暗是因为生成了过氧化钠 | |
| B. | “出汗”是因为NaOH 具有吸湿性 | |
| C. | 从“出汗”→变成白色固体(粉末)的过程中只发生了物理变化 | |
| D. | 最后得到的白色固体是NaOH |
1.配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时,在天平托盘上放上称量纸,将NaOH固体放在纸上称量 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
8.下列化合物中,只含有共价键的是( )
| A. | H2O | B. | CaCl2 | C. | NaCl | D. | NaOH |
5.设阿伏伽德罗常数的值为NA,则下列说法正确的是( )
| A. | 标准状况下,11.21CCl4所含的分子数为0.5NA | |
| B. | 常温常压下,4.2gC2H4和C9H18混合物中含有的碳原子数为0.3NA | |
| C. | 7.8g苯分子中碳碳双键的数目为0.3NA | |
| D. | 常温下,1molC3H8含有C-H共价键数为10NA |
 如图是NO2与CO发生可逆反应过程中的能量变化示意图,请回答下列问题.
如图是NO2与CO发生可逆反应过程中的能量变化示意图,请回答下列问题.