题目内容
6.下列各项叙述正确的是( )| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
分析 A.一般以最高价氧化物对应水化物的酸性强弱为判断依据;
B.Na在氧气中燃烧主要生成过氧化钠;
C.第3周期非金属元素从左到右元素的非金属性增强;
D.原子核外电子排布决定元素的性质.
解答 解:A.从HF、HCl、HBr、HI酸性递增的事实,说明H-X键稳定性减弱,故F、Cl、Br、I的非金属递减,故A错误;
B.Na在氧气中燃烧主要生成过氧化钠,不加热时生成氧化钠,故B错误;
C.第3周期非金属元素从左到右元素的非金属性增强,最高价氧化物的水化物的酸性增强,故C错误;
D.原子核外电子排布决定元素的性质,元素周期律是元素原子核外电子排布周期性变化的结果,故D正确.
故选D.
点评 本题考查了元素周期律的实质、离子化合物中微粒间存在的作用力等知识点,为高频考点,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
15.下列反应属于吸热反应的是( )
| A. | 燃烧木炭 | B. | 酸碱中和反应 | ||
| C. | 锌粒与稀硫酸反应制取H2 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
1.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第4周期ⅥA族元素,根据它在周期表中的位置推测硒不可能具有的性质为( )
| A. | 硒化氢不稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 得电子能力强于硫 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
11.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
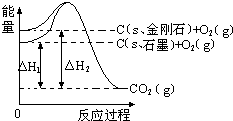

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
18.有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+.现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336mL.
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336mL,该气体能使品红溶液褪色.
根据上述实验,下列推断正确的是( )
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336mL.
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336mL,该气体能使品红溶液褪色.
根据上述实验,下列推断正确的是( )
| A. | K+一定存在 | |
| B. | Ag+和Cl-一定不存在 | |
| C. | HCO3-一定不存在 | |
| D. | 混合溶液中一定有0.015 mol SO32- |
15.下列说法中,正确的是( )
| A. | 任何溶液中,c(H+)×c(OH-)=1.0×10-14 | |
| B. | pH=0的溶液呈中性 | |
| C. | 酸性溶液中,c(H+)越大,酸性越强 | |
| D. | 酸性溶液中没有OH-,碱性溶液里没有H+ |
16.下列描述的过程中的能量变化与如图一致的是( )


| A. | 反应物总键能比生成物总键能大 | B. | H-H键断裂 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
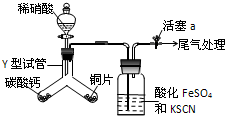 (1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
(1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.