题目内容
18.有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+.现取等体积的两份溶液进行如下实验:(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336mL.
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336mL,该气体能使品红溶液褪色.
根据上述实验,下列推断正确的是( )
| A. | K+一定存在 | |
| B. | Ag+和Cl-一定不存在 | |
| C. | HCO3-一定不存在 | |
| D. | 混合溶液中一定有0.015 mol SO32- |
分析 K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+.这些离子中能和氢氧化钠反应的有NH4+、HCO3-、Ag+.其中铵根离子和氢氧根离子反应生成氨气和水,所以第一份加入足量的NaOH溶液,无沉淀说明无银离子;加热,收集到标准状况下的气体336mL为氨气,第二份加入足量的用盐酸酸化的BaCl2溶液,因硫酸根离子和钡离子生成白色硫酸钡淀,所以产生2.33g白色沉淀为硫酸钡,能使品红褪色的为二氧化硫,但二氧化硫二氧化碳的混合气体能使品红褪色,据此解答.
解答 解:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+.现取等体积的两份溶液进行如下实验:
(1)银离子和氢氧根离子反应生成氢氧化银沉淀,氢氧化银不稳定,分解生成黑色氧化银沉淀,第一份加入足量的NaOH溶液,无沉淀说明一定没有银离子;
NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,加热,收集到标准状况下的气体336mL,氨气的物质的量为0.015mol,说明一定含有铵根离子,物质的量为0.015mol;
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,硫酸根离子和钡离子生成白色硫酸钡沉淀,产生2.33g白色沉淀为硫酸钡,说明硫酸根离子的物质的量为0.01mol;
SO32-+2H+=H2O+SO2↑,二氧化硫能使品红褪色,说明一定含有亚硫酸根离子;
碳酸氢根离子和氢离子反应生成碳酸,碳酸分解生成二氧化碳和水,二氧化硫和二氧化碳的混合气体能使品红褪色,说明可能含有碳酸氢根离子;
当收集到标准状况下的气体336mL为二氧化硫时,亚硫酸根离子的物质的量为0.015mol;当收集到标准状况下的气体336mL为二氧化硫和二氧化碳的混合气体,碳酸氢根离子和亚硫酸根离子的物质的量为0.015mol;
综上该溶液中:一定存在SO42-和SO32-和NH4+,一定不存在Ag+,可能存在HCO3-,根据溶液呈电中性,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,溶液中SO42-的物质的量为0.01mol,带0.02mol的负电荷,NH4+为0.015mol,带0.015mol的正电荷,所以溶液中必须存在K+,无法确定是否含有Cl-,所以A正确,
故选A.
点评 本题考查了离子的检验,掌握相关的化学反应方程式是解答的关键,题目难度中等.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案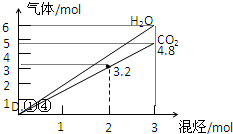 两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①一定有乙烯;②一定有甲烷;③一定有丙烷;
④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.
| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |

| A. | 转移0.1mol电子时,a电极产生1.12LH2 | |
| B. | b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- | |
| C. | c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池 | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 检验Cl-:确定无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色 | |
| D. | 检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
 ;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为
;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为 或
或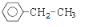 .
.