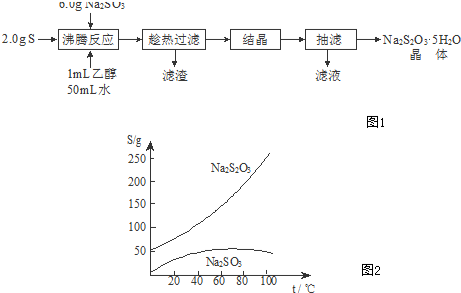
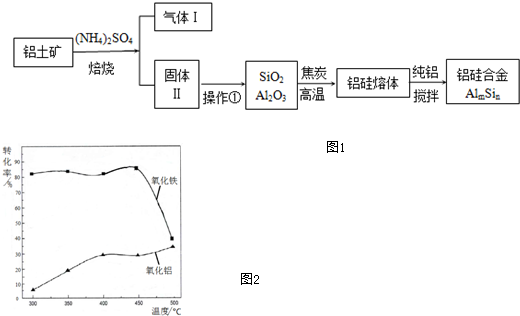
题目内容
16.(1)下列5种固态物质:P4(白磷)、Na2O、NaOH、MgCl2、金刚石,回答下列问题(填写化学式或名称):①熔化时不需要破坏化学键的是P4,熔化时需要破坏共价键的是金刚石;
②晶体中既有离子键又有共价键的是NaOH.
③P4(白磷)、金刚石、MgCl2三种晶体熔点由高到低的顺序为金刚石>MgCl2>P4(白磷).
(2)某元素有正价,也有负价,最低价为-2,其最高价为+6.某元素R与H形成的气态氢化物的化学式为RH3,它最高价氧化物的化学式为R2O5.
分析 (1)①分子晶体熔化时破坏分子间作用力;原子晶体熔化时破坏共价键;
②活泼金属与活泼非金属之间形成离子键,非金属之间形成共价键;
③熔点的一般规律:原子晶体>离子晶体>分子晶体;
(2)元素的最高正化合价与最低负化合价的绝对值之和为8;根据化合物中化合价的代数和为零分析.
解答 解:(1)①P4属于分子晶体,熔化时破坏分子间作用力;金刚石属于原子晶体,熔化时破坏共价键;
故答案为:P4;金刚石;
②活泼金属与活泼非金属之间形成离子键,铵根离子与阴离子之间形成离子键,非金属之间形成共价键,则晶体中既有离子键又有共价键的是NaOH;
故答案为:NaOH;
③金刚石属于原子晶体,MgCl2属于离子晶体,白磷属于分子晶体,常温下白磷为固体,则熔点:金刚石>MgCl2>P4(白磷);
故答案为:金刚石>MgCl2>P4(白磷);
(2)已知元素最低价为-2,则其最高正价为+6;某元素R与氢形成的气态氢化物的化学式为RH3,则R的负价为-3,所以最高正化合价为+5,则其最高价氧化物的化学式为R2O5,
故答案为:+6;R2O5.
点评 本题考查了离子键、共价键、物质熔沸点的比较等,明确这几个概念的内涵是解本题关键,注意这几个概念的区别,比较容易.

练习册系列答案
相关题目
6.能鉴别CO2和SO2的试剂是( )
| A. | 紫色石蕊试液 | B. | 氯化钡溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 澄清石灰水 |
7.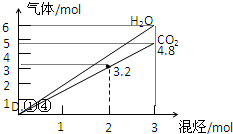 两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
则下列对混合烃的判断正确的是( )
①一定有乙烯;②一定有甲烷;③一定有丙烷;
④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.
 两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①一定有乙烯;②一定有甲烷;③一定有丙烷;
④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.
| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
4.进行一氯取代反应后,只能生成3种沸点不同的有机产物的烷烃是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3CH2)2CHCH3 |
11.下列反应或过程对能量的变化如图所示的是( )


| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
6.下列各项叙述正确的是( )
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
7.某主族元素的电离能(单位:kJ•mol-1)如下表,此元素位于元素周期表的族数是( )
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |