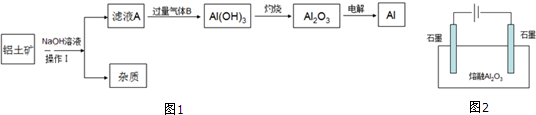
题目内容
5.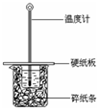 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.(1)图示实验装置中缺少的一种仪器是环形玻璃搅拌棒,大、小烧杯间填满碎纸条的作用是保温、隔热防止热量散失.
(2)氢氧化钠溶液稍过量的原因是保证盐酸能够完全被中和.
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会:偏小.(填“偏大”、“偏小”或“无影响”)
(4)实际实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是abcd(填字母).
a.实验装置保温、隔热效果差
b.用量筒量取盐酸时俯视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度.
分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;根据中和热的实验的关键是保温;
(2)为了保证酸或碱中的一方完全反应,往往保证另一方过量;
(3)根据弱电解质电离吸热;
(4)a.实验装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;保温、隔热防止热量散失;
(2)为了确保盐酸被完全中和,所用氢氧化钠溶液稍过量,故答案为:保证盐酸能够完全被中和;
(3)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;
(4)a、实验装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.用量筒量取盐酸时俯视读数,会导致所量的盐酸体积偏小,放出的热量偏低,中和热的数值偏小,故b正确;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故选:abcd.
点评 本题考查中和热测定原理及误差分析,题目难度大,注意理解测定中和热的原理是解题的关键.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
12.气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量而造成温室效应.下列不属于造成温室效应气体的是( )
| A. | CO2 | B. | N2O | C. | CH4 | D. | N2 |
13.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2LCO2所含的原子数为1.5NA | |
| B. | 常温常压下,48gO2与O3混合物含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LCCl4中所含分子数为NA | |
| D. | 标准状况下,18g水所含原子数为NA |
13.下列不是海水淡化方法的是( )
| A. | 蒸馏法 | B. | 电渗析法 | C. | 热蒸发法 | D. | 离子交换法 |
10. 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol.
(3)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol.
(3)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
17.用于制造隐形飞机物质具有吸收微波的功能,其主要成分的结构如图,说法不正确的是( )
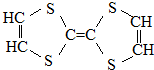

| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |