题目内容
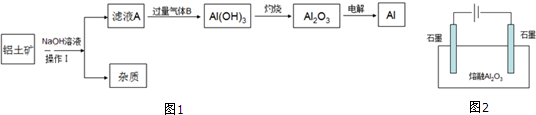
15.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:
①沉淀 A、B的成分分别是SiO2、Fe(OH)3;步骤②中的试剂a是NaOH溶液;
②试写出步骤③中发生反应的离子方式CO2+OH-=HCO3-、CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;
③试写出步骤③中滤液分解反应的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
④简述氯化铝溶液经过结晶得到氯化铝晶体的实验条件是将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解.
分析 铝土矿的主要成分是Al2O3,含SiO2、Fe2O3等杂质,由流程可知,加足量盐酸过滤得到沉淀A为SiO2,溶液甲中含Al3+、Fe3+,加过量NaOH溶液过滤得到沉淀B为Fe(OH)3,溶液乙中含偏铝酸根离子,通入过量二氧化碳后过滤得到Al(OH)3,Al(OH)3受热分解得氧化铝,
①氧化铝是两性氧化物,既溶液强酸又溶于强碱.Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸;①为盐酸时,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅;②为氢氧化钠溶液,将铁离子变成氢氧化铁沉淀除去铁离子,将铝离子转化为偏铝酸根,进入乙;滤液②含有AlO2-,步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-;
②滤液乙含有OH-、AlO2-,步骤③通入二氧化碳,与OH-反应生成碳酸氢根离子,与AlO2-反应生成的沉淀为氢氧化铝;
③步骤③中滤液为碳酸氢钠溶液,受热分解生成碳酸钠、水和二氧化碳;
④氯化铝溶液中铝离子水解,所以从氯化铝溶液得到氯化铝晶体抑制铝离子的水解.
解答 解:①氧化铝是两性氧化物,既溶液强酸又溶于强碱.Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸;①为盐酸时,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅;②为氢氧化钠溶液,将铁离子变成氢氧化铁沉淀除去铁离子,将铝离子转化为偏铝酸根,进入乙,步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为 H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O,
故答案为:SiO2;Fe(OH)3;NaOH溶液;
②步骤③中与OH-反应生成碳酸氢根离子:CO2+OH-=HCO3-,四羟基合铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,反应方程式为Na〔Al(OH)4〕+CO2═Al(OH)3↓+NaHCO3,离子反应为:CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-,
故答案为:CO2+OH-=HCO3-;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;
③步骤③中滤液为碳酸氢钠溶液,受热分解生成碳酸钠、水和二氧化碳,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
④氯化铝溶液中铝离子水解,所以从氯化铝溶液得到氯化铝晶体抑制铝离子的水解,实验条件是将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解,
故答案为:将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解.
点评 本题考查物质的分离、提纯的方法及基本操作的综合应用,为高频考点,把握流程中物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,题目难度不大.

| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 多饮用纯净水,少饮用矿泉水 |
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 可燃性气体的验纯 | |
| C. | 气体实验装置在实验前进行气密性检查 | |
| D. | 分液时,上层的液体由上端瓶口倒出 |
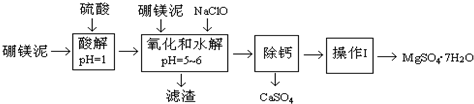
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器是烧杯、100mL容量瓶.
(2)滤渣的主要成份有Fe(OH)3、Al(OH)3、MnO2、SiO2
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O═MnO2↓+2H++Cl-.在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为70%(相对分子质量:MgSO4•7H2O-246 MgO-40).
| A. | 它是高分子化合物 | |
| B. | 它在一定条件下能水解,最终生成葡萄糖 | |
| C. | 是天然蛋白质,仅由C、H、O、N四种元素组成 | |
| D. | 是一种特殊的蛋白质,滴加浓HNO3不发生颜色反应,灼烧时没有任何气味 |
| A. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| B. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 物质燃烧都需要氧气 | |
| D. | 物质燃烧放出热最的多少与外界条件有关 |