题目内容
钛有强度高和质地轻的优点,广泛应用于飞机制造业等.工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下:
已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等.
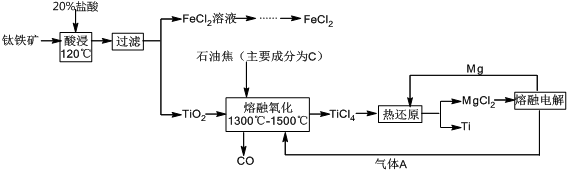
(1)请写出FeTiO3与稀盐酸反应的离子方程式: .
(2)请写出“熔融氧化”的化学方程式: .
(3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式).
(4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: .
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式).
已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等.

(1)请写出FeTiO3与稀盐酸反应的离子方程式:
(2)请写出“熔融氧化”的化学方程式:
(3)电解氯化镁的阴极反应式为:
(4)热还原法中能否改用钠代替镁作还原剂:
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是
考点:物质的分离、提纯的基本方法选择与应用
专题:实验设计题
分析:(1)钛铁矿的主要成分为钛酸亚铁(FeTiO3),根据流程可知,钛酸亚铁与稀盐酸反应生成了氯化亚铁和二氧化钛;
(2)二氧化钛与碳、氯气在1300℃-1500℃熔融氧化生成一氧化碳和四氯化钛,据此写出反应的化学方程式;
(3)电解熔融氯化镁,阴极镁离子得到电子生成金属镁;电解氯化镁生成的氯气和镁可以循环利用;
(4)根据钠与金属镁的还原性强弱进行解答;
(5)根据金属钛不溶于稀硫酸、稀盐酸选用除杂试剂.
(2)二氧化钛与碳、氯气在1300℃-1500℃熔融氧化生成一氧化碳和四氯化钛,据此写出反应的化学方程式;
(3)电解熔融氯化镁,阴极镁离子得到电子生成金属镁;电解氯化镁生成的氯气和镁可以循环利用;
(4)根据钠与金属镁的还原性强弱进行解答;
(5)根据金属钛不溶于稀硫酸、稀盐酸选用除杂试剂.
解答:
解:(1)根据工艺流程可知,FeTiO3与稀盐酸反应生成了氯化亚铁和二氧化钛,反应的离子方程式为:FeTiO3+2H+
Fe2++TiO2+H2O,
故答案为:FeTiO3+2H+
Fe2++TiO2+H2O;
(2)二氧化钛的“熔融氧化”为:二氧化钛与碳、氯气在1300℃-1500℃熔融氧化生成一氧化碳和四氯化钛,反应的化学方程式为:TiO2+2C+2Cl2
TiCl4+2CO,
故答案为:TiO2+2C+2Cl2
TiCl4+2CO;
(3)电解熔融的氯化镁,阴极镁离子得到电子发生还原反应生成金属镁,电极反应式为:Mg2++2e-=Mg;电解熔融氯化镁生成金属镁和氯气,根据流程可知,金属镁和氯气都可以循环利用,
故答案为:Mg2++2e-=Mg; Cl2和Mg;
(4)由于钠的还原性强于镁,所以热还原法中可以改用钠代替镁作还原剂,
故答案为:能;钠的还原性比镁强;
(5)金属钛不溶于稀盐酸、稀硫酸,而杂质镁能够与稀盐酸、稀硫酸反应,故可以使用稀盐酸或稀硫酸为除杂试剂,除去钛中混有的杂质镁,
故答案为:HCl(填写H2SO4、HNO3均可).
| ||
故答案为:FeTiO3+2H+
| ||
(2)二氧化钛的“熔融氧化”为:二氧化钛与碳、氯气在1300℃-1500℃熔融氧化生成一氧化碳和四氯化钛,反应的化学方程式为:TiO2+2C+2Cl2
| ||
故答案为:TiO2+2C+2Cl2
| ||
(3)电解熔融的氯化镁,阴极镁离子得到电子发生还原反应生成金属镁,电极反应式为:Mg2++2e-=Mg;电解熔融氯化镁生成金属镁和氯气,根据流程可知,金属镁和氯气都可以循环利用,
故答案为:Mg2++2e-=Mg; Cl2和Mg;
(4)由于钠的还原性强于镁,所以热还原法中可以改用钠代替镁作还原剂,
故答案为:能;钠的还原性比镁强;
(5)金属钛不溶于稀盐酸、稀硫酸,而杂质镁能够与稀盐酸、稀硫酸反应,故可以使用稀盐酸或稀硫酸为除杂试剂,除去钛中混有的杂质镁,
故答案为:HCl(填写H2SO4、HNO3均可).
点评:本题考查了物质的分离与提纯、物质制备实验方案的设计,题目难度中等,注意掌握常见物质的分离与提纯方法,明确生成流程为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列反应的离子方程式书写不正确的是( )
| A、小苏打溶液显碱性:HCO3-+H2O═H2CO3+OH- |
| B、FeCl3溶液中滴加过量的氨水:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ |
| C、CuSO4溶液中滴加过量的氨水:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O |
| D、向FeSO4溶液中加少量过氧化钠粉末:6H2O+4Na2O2+4Fe2+═4Fe(OH)3↓+O2↑+8Na+ |
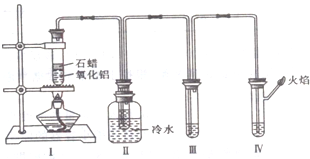
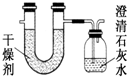 已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).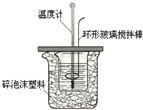 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: 合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产.
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产.