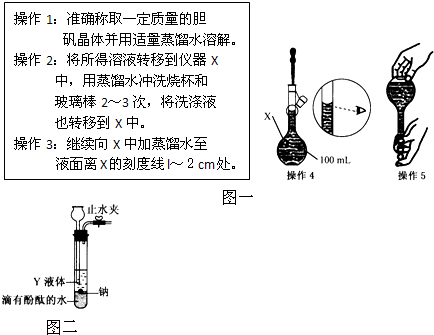
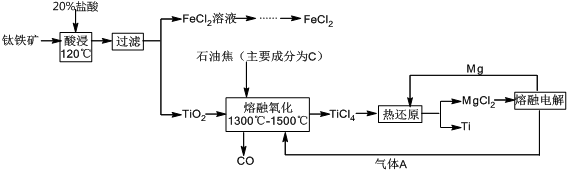
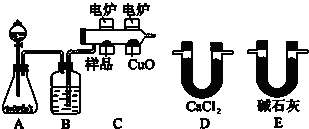
题目内容
重水(D2O)的离子积Kw=1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],试求该温度下:
①重水的pD=?
②含0.01molNaOD的D2O溶液1L其pD=?
③溶解0.01molDCl的D2O溶液1L其pD=?
④在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=?
①重水的pD=?
②含0.01molNaOD的D2O溶液1L其pD=?
③溶解0.01molDCl的D2O溶液1L其pD=?
④在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=?
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:①重水(D2O)的离子积为Kw=c(D+)?c(OD-)=1.6×10-14,中性溶液中c(D+)=c(OD-),据此计算出c(D+)及其pD;
②该NaOD的D2O溶液中c(OD-)=10-2mol/L,根据重水的离子积常数计算出NaOD溶液中氢离子浓度及溶液的pD;
③溶解0.01molDCl的D2O溶液1L,该DCl溶液的浓度为0.01nol/L,据此计算出该溶液的pD;
④先算出n(DC)、n(NaOD)的物质的量,判断反应后溶液酸碱性,然后进行求算溶液的pD.
②该NaOD的D2O溶液中c(OD-)=10-2mol/L,根据重水的离子积常数计算出NaOD溶液中氢离子浓度及溶液的pD;
③溶解0.01molDCl的D2O溶液1L,该DCl溶液的浓度为0.01nol/L,据此计算出该溶液的pD;
④先算出n(DC)、n(NaOD)的物质的量,判断反应后溶液酸碱性,然后进行求算溶液的pD.
解答:
解:①重水(D2O)的离子积为Kw=c(D+)?c(OD-)=1.6×10-14,中性溶液中c(D+)=c(OD-),则c(D+)=
=
=4×10-8mol/L,pD=-lg4×10-8=8-2lg2≈7.4,
答:重水的pD=7.4;
②该NaOD的D2O溶液的浓度为0.01mol/L,OD-离子的浓度为:c(D+)=
mol/L=1.6×10-13mol/L,则pD=-lg1.6×10-13=-lg16×10-14=14-4lg2≈12.8,
答:含0.01molNaOD的D2O溶液1L其pD=12.8;
③溶解0.01molDCl的D2O溶液1L,该溶液中D+离子浓度为0.01mol/L,该溶液的pD=-lg0.01=2,
答:溶解0.01molDCl的D2O溶液1L其pD=2;
④n(DCl)=0.25mol/L×0.1L=0.025mol,n(NaOD)=0.2mol/L×0.05L=0.01mol,D+有剩余,剩余的n(D+)=0.025mol-0.01mol=0.015mol,反应后溶液中,c(D+)=
=0.1mol/L,
则pD=-lg0.1=1,
答:反应后的混合液的pD=1.
| Kw |
| 1.6×10-15 |
答:重水的pD=7.4;
②该NaOD的D2O溶液的浓度为0.01mol/L,OD-离子的浓度为:c(D+)=
| 1.6×10-15 |
| 0.01 |
答:含0.01molNaOD的D2O溶液1L其pD=12.8;
③溶解0.01molDCl的D2O溶液1L,该溶液中D+离子浓度为0.01mol/L,该溶液的pD=-lg0.01=2,
答:溶解0.01molDCl的D2O溶液1L其pD=2;
④n(DCl)=0.25mol/L×0.1L=0.025mol,n(NaOD)=0.2mol/L×0.05L=0.01mol,D+有剩余,剩余的n(D+)=0.025mol-0.01mol=0.015mol,反应后溶液中,c(D+)=
| 0.015mol |
| 0.1L+0.05L |
则pD=-lg0.1=1,
答:反应后的混合液的pD=1.
点评:本题考查了有关pH的计算、酸碱混合的定性判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,要求学生能够利用pH计算方法进行计算该溶液的pD值,试题培养了学生的知识迁移能力.

练习册系列答案
相关题目
下列物质中,属于氧化物的是( )
| A、H3PO4 |
| B、KOH |
| C、MgO |
| D、AgNO3 |
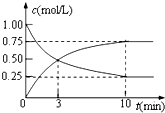 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)