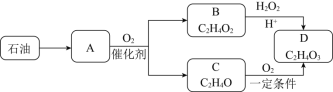
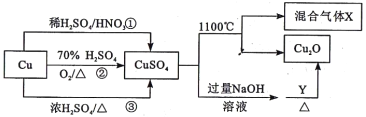
题目内容
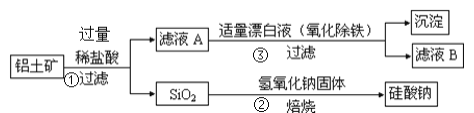
【题目】工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下,下列有关说法不正确的是( )
A.向滤液A中加入KSCN溶液,溶液一定会变红
B.![]() 的离子反应方程式为
的离子反应方程式为![]()
C.![]() 漂白液的目的是氧化除铁,该过程中涉及的氧化还原反应为
漂白液的目的是氧化除铁,该过程中涉及的氧化还原反应为![]()
D.![]() 中漂白液要适量,若过量则可能产生有毒的气体氯气
中漂白液要适量,若过量则可能产生有毒的气体氯气
【答案】B
【解析】
由流程可知,铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硅,滤液A中含有铁离子、亚铁离子和铝离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硅与氢氧化钠在铁坩埚中焙烧生成硅酸钠。
A项、铁离子能和KSCN反应生成络合物硫氰化铁而显红色,A中含有铁离子,所以加入KSCN溶液,溶液一定会变红,故A正确;
B项、②为二氧化硅和NaOH固体的反应,没有离子方程式,故B错误;
C项、③中漂白液具有氧化性,能氧化还原性离子亚铁离子生成铁离子,离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,故C正确;
D项、漂白液具有强氧化性,盐酸具有还原性,③中漂白液能和盐酸反应生成氯气,所以③中漂白液要适量,若过量则可能产生有毒的气体氯气,故D正确;
故选B。

【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: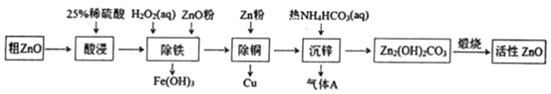
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O