题目内容
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
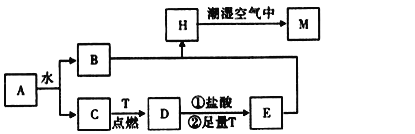
(1)物质A的化学式为___。
(2)H在潮湿空气中变成M的实验现象是__,化学方程式为___。
(3)A和水反应生成B和C的离子方程式为__,列出A的一种重要用途__。
(4)反应①的离子方程式为__,②加足量T的目的___。
【答案】Na2O2 白色沉淀迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2O2+2H2O=4Na++4OH-+O2↑ 供氧剂(或漂白剂) Fe3O4+8H+=Fe2++2Fe3++4H2O 使Fe3+全部还原为Fe2+
【解析】
A为淡黄色固体,且A与水反应生成无色无味C,则A为Na2O2,B为NaOH,C为O2,T为生活中使用最广泛的金属单质,且T与氧气反应生成的D具有磁性的黑色晶体,则T为Fe,D为Fe3O4,四氧化三铁与足量的盐酸、足量的Fe反应得到E,E与B(NaOH)反应得到白色沉淀H,则E为FeCl2,H是Fe(OH)2,H在潮湿的空气中得到M为Fe(OH)3,以此解答该题。
(1)由以上分析可知A为Na2O2,故答案为:Na2O2;
(2)Fe(OH)2在潮湿空气中变成Fe(OH)3的过程中,可能观察到的现象:白色沉淀迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色; 4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)A和水反应生成B和C的离子方程式为2Na2O2+2H2O═4Na++4OH+O2↑,由此反应可知A有作为供氧剂的用途,故答案为:2Na2O2+2H2O═4Na++4OH+O2↑;供氧剂(或漂白剂);
(4)步骤①的反应为四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应的离子方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
②A为淡黄色固体,且A与水反应生成无色无味C,则A为Na2O2,B为NaOH,C为O2,T为生活中使用最广泛的金属单质,且T与氧气反应生成的D具有磁性的黑色晶体,则T为Fe,因此加足量T的目的是为了使使Fe3+全部还原为Fe2+,故答案为:使Fe3+全部还原为Fe2+。

 备战中考寒假系列答案
备战中考寒假系列答案