ƒøƒ⁄»ð
°æƒø°ø«¶º∞∆‰ªØ∫œŒÔ‘⁄𧓵…˙≤˙°¢…˙ªÓ÷–æþ”–∑«≥£π„∑∫µƒ”√Õæ°£
£®1£©Õþ≈¶ø∆∑Ú∑®»€¡∂«¶£¨∆‰œýπÿ∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã Ω»Áœ¬£∫
¢Ÿ2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) °˜H1£ΩakJ°§mol-1
¢⁄PbS(s)2PbO(s)=3Pb(s)+SO2(g) °˜H2£Ωb kJ°§mol-1
¢€PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) °˜H3£Ωc kJ°§mol-1
∑¥”¶3PbS(s)+6O2(g)=3PbSO4(s) °˜H£Ω____________kJ°§mol-1£®”√∫¨a°¢b°¢cµƒ¥˙ ˝ Ω±Ì æ£©
£®2£©“‘∫¨«¶∑œ¡œ£®÷˜“™∫¨Pb°¢PbO°¢PbO2°¢PbSO4£©Œ™‘≠¡œ÷∆±∏∏þ¥øPbO£¨∆‰÷˜“™¡˜≥ûÁœ¬£∫
¢Ÿ°∞À·»Ð°± ±£¨‘⁄Fe2+¥þªØœ¬£¨Pb∫ÕPbO2∑¥”¶≥…1 mol PbSO4 ±◊™“∆µÁ◊”µƒŒÔ÷ µƒ¡øŒ™_________ mol°£
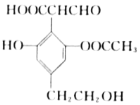
¢⁄“—÷™£∫PbO»ÐΩ‚‘⁄NaOH»Ð“∫÷–£¨¥Ê‘⁄ªØ—ß∆Ω∫‚£∫PbO(s)+NaOH(aq)![]() NaHPbO2(aq)£¨∆‰»ÐΩ‚∂»«˙œþ»ÁÕº1À˘ æ£∫
NaHPbO2(aq)£¨∆‰»ÐΩ‚∂»«˙œþ»ÁÕº1À˘ æ£∫

Ω·∫œ…œ ˆ–≈œ¢£¨ÕÍ≥…”…¥÷∆∑PbO£®À˘∫¨‘”÷ ≤ª»Ð”⁄NaOH»Ð“∫£©µ√µΩ∏þ¥øPbOµƒ≤Ÿ◊˜£∫Ω´¥÷∆∑PbO»ÐΩ‚‘⁄“ª∂®¡ø________£®ÃÓ°∞35£•°±ªÚ°∞10£•°±£©µƒNaOH»Ð“∫÷–£¨º”»»÷¡110°Ê£¨≥‰∑÷»ÐΩ‚∫Û£¨_______________£®ÃÓ °∞≥√»»π˝¬À°±ªÚ°∞’Ù∑¢≈®Àı°±£©£¨Ω´¬À“∫¿‰»¥Ω·æߣ¨π˝¬À°¢œ¥µ”≤¢∏…‘Ôµ√µΩ∏þ¥øPbOπÃð£
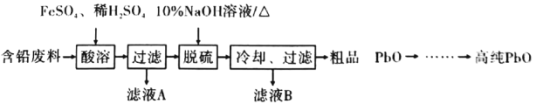
£®3£©Ω´¥÷∆∑PbO»ÐΩ‚‘⁄HCl∫ÕNaClµƒªÏ∫œ»Ð“∫÷–£¨µ√µΩ∫¨Na2PbCl4µƒµÁΩ‚“∫£¨µÁΩ‚Na2PbCl4»Ð“∫…˙≥…Pbµƒ◊∞÷√»ÁÕº2À˘ æ£∫

¢Ÿ“ıº´µƒµÁº´∑¥”¶ ΩŒ™______________________£ª
¢⁄µ±”–4.14gPb…˙≥… ±£¨Õ®π˝÷ ◊”Ωªªªƒ§µƒn(H+)=______________________°£
£®4£©PbI2ø…”√”⁄»Àπ§Ωµ”Í°£»°“ª∂®¡øµƒPbI2πÃ㨔√’Ù¡ÛÀÆ≈‰÷∆≥…t°Ê±•∫ջГ∫£¨◊º»∑“∆»°25.00 mL PbI2±•∫ջГ∫∑÷¥Œº”»Î—Ù¿Î◊”Ωªªª ˜÷¨RH+£®∑¢…˙∑¥”¶£∫2RH++PbI2 =R2Pb+2H++2I-£©£¨”√250mlΩý檵ƒ◊∂–Œ∆øΩ” ’¡˜≥ˆ“∫£¨∫Û”√’Ù¡ÛÀÆ¡Ðœ¥ ˜÷¨÷¡¡˜≥ˆ“∫≥ ÷––‘£¨Ω´œ¥µ”“∫“ª≤¢ ¢∑≈µΩ◊∂–Œ∆ø÷–£®»ÁÕº3£©°£º”»Î∑”Ù÷∏ 溡£¨”√0.0050mol°§L-1NaOH»Ð“∫µŒ∂®£¨µ±¥ÔµΩµŒ∂®÷’µ„ ±£¨”√»•«‚—ıªØƒ∆»Ð“∫10.00mL°£ø…º∆À„≥ˆt°Ê ±Ksp(PbI2)Œ™_________________°£
°æ¥∞∏°ø 2a+2b-3c 1 35% ≥√»»π˝¬À PbCl42-+2e-=Pb+4Cl- 0.04mol 4°¡10-9
°æΩ‚Œˆ°ø£®1£©∏˘æð∏«Àπ∂®¬… È–¥ƒø±Í»»ªØ—ß∑Ω≥Ã Ω£ª
(2) ¢Ÿ∏˘æðµ√ ßµÁ◊” ÿ∫„º∆À„¢⁄Õ—¡Úπ˝≥Ã÷–∑¢…˙µƒ∑¥”¶Œ™PbSO4+2NaOH=PbO+Na2SO4+H2O£¨∂¯¬À“∫¢Ò÷–∫¨”–¡ÚÀ·£¨ø…ΩµµÕ»Ð“∫µƒpH£¨ π∆Ω∫‚PbO£®s£©+NaOH£®aq£©NaHPbO2£®aq£©ƒÊœÚ“∆∂Ø£¨Ω·∫œ»ÐΩ‚∂»«˙œþÃÿµ„ø…÷™≈®∂»∏þµƒNaOH»Ð“∫∫ÕΩœ∏þµƒŒ¬∂»£¨PbOµƒ»ÐΩ‚∂»∏þ£¨æð¥À∑÷Œˆ£ª
£®3£©¢Ÿ“ıº´∑¢…˙ªπ‘≠∑¥”¶£ª¢⁄∏˘æð◊™“∆µƒµÁ◊” ˝«ÛÕ®π˝÷ ◊”Ωªªªƒ§µƒn(H+)
£®4£©“™º∆À„≥ˆt°Ê ±PbI2Ksp£¨«Û»Ð“∫÷–CI2ªÚ’þCPbµƒ÷µ£¨»ª∫Û∏˘æðπ´ Ω«Û≥ˆΩ·π˚£Æ
(1)¢Ÿ2PbS(s)+3O2(g)®T2PbO(s)+2SO2(g)°˜H1=akJmol1
¢⁄PbS(s)+2PbO(s)®T3Pb(s)+SO2(g)°˜H2=bkJmol1
¢€PbS(s)+PbSO4(s)®T2Pb(s)+2SO2(g)°˜H3=ckJmol1
∏˘æð∏«Àπ∂®¬…¢Ÿ°¡2+¢⁄°¡2¢€°¡3µ√µΩ3PbS(s)+6O2(g)®T3PbSO4(s)°˜H=2°˜H1+2°˜H23°˜H3=(2a+2b3c)kJmol1£¨π ¥∞∏Œ™£∫2a+2b3c£ª
£®2£©¢Ÿ‘⁄Fe2+¥þªØœ¬£¨Pb∫ÕPbO2∑¥”¶…˙≥…PbSO4£¨∑¥”¶Œ™£∫Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O£¨…˙≥…2molPbSO4◊™“∆µÁ◊”2mol£¨π …˙≥…1molPbSO4£¨◊™“∆µÁ◊”µƒŒÔ÷ µƒ¡ø «1mol¢⁄∏˘æðPbOµƒ»ÐΩ‚∂»«˙œþ£¨Ã·¥ø¥÷Pbµƒ∑Ω∑®Œ™Ω´¥÷PbO»ÐΩ‚‘⁄NaOH»Ð“∫÷–£¨Ω·∫œ»ÐΩ‚∂»«˙œþÃÿµ„ø…÷™≈®∂»∏þµƒNaOH»Ð“∫∫ÕΩœ∏þµƒŒ¬∂»£¨PbOµƒ»ÐΩ‚∂»∏þ£¨“Ú¥Àº”»»÷¡Ωœ∏þŒ¬∂»£¨≥‰∑÷»ÐΩ‚£¨»ª∫Û‘Ÿ∏þŒ¬œ¬≥√»»π˝¬À≥˝»•‘”÷ £¨Ω´¬À“∫¿‰»¥Ω·æߣ¨π˝¬À°¢œ¥µ”≤¢∏…‘Ôµ√µΩ∏þ¥øPbOπÃãªπ ¥∞∏Œ™£∫¢Ÿ1¢⁄35%£ª≥√»»π˝¬À£ª
2PbSO4+2H2O£¨…˙≥…2molPbSO4◊™“∆µÁ◊”2mol£¨π …˙≥…1molPbSO4£¨◊™“∆µÁ◊”µƒŒÔ÷ µƒ¡ø «1mol¢⁄∏˘æðPbOµƒ»ÐΩ‚∂»«˙œþ£¨Ã·¥ø¥÷Pbµƒ∑Ω∑®Œ™Ω´¥÷PbO»ÐΩ‚‘⁄NaOH»Ð“∫÷–£¨Ω·∫œ»ÐΩ‚∂»«˙œþÃÿµ„ø…÷™≈®∂»∏þµƒNaOH»Ð“∫∫ÕΩœ∏þµƒŒ¬∂»£¨PbOµƒ»ÐΩ‚∂»∏þ£¨“Ú¥Àº”»»÷¡Ωœ∏þŒ¬∂»£¨≥‰∑÷»ÐΩ‚£¨»ª∫Û‘Ÿ∏þŒ¬œ¬≥√»»π˝¬À≥˝»•‘”÷ £¨Ω´¬À“∫¿‰»¥Ω·æߣ¨π˝¬À°¢œ¥µ”≤¢∏…‘Ôµ√µΩ∏þ¥øPbOπÃãªπ ¥∞∏Œ™£∫¢Ÿ1¢⁄35%£ª≥√»»π˝¬À£ª
£®3£©¢Ÿ“ıº´∑¢…˙ªπ‘≠∑¥”¶£¨∏˘æð“‚µÁΩ‚Na2PbCl4»Ð“∫£¨…˙≥…Pb£¨∑¢…˙ªπ‘≠∑¥”¶£¨π “ıº´∑¥”¶Œ™£∫PbCl42-+2e-=Pb+4Cl-£ª¢⁄µ±”–4.14gPb…˙≥… ±£¨◊™“∆¡À0.04molµÁ◊”£¨“Ú¥ÀÕ®π˝÷ ◊”Ωªªªƒ§µƒn(H+)0.04mol£ªπ ¥∞∏Œ™£∫¢ŸPbCl42-+2e-=Pb+4Cl- ¢⁄0.04mol
£®4£©µŒ∂®π˝≥Ã÷–œ˚∫ƒµƒOH-£¨º¥Œ™—Ù¿Î◊”Ωªªª≥ˆµƒH+£¨c(H+)=0.0025molL-1°¡20.00mL°¬25.00mL=2°¡10-3molL-1£¨”…2RH++PbI2 =R2Pb2++2H++2I-ø…÷™c(H+)= c(I-)£¨∂¯c(Pb2+)= c(I-)/2=10-3£¨À˘“‘![]() 4°¡10-9
4°¡10-9
£¨π ¥∞∏Œ™4°¡10-9°£

°æƒø°ø800°Ê ±£¨‘⁄2Lµƒ√б’»ð∆˜÷–∑¢…˙∑¥”¶£∫2NO(g)+O2(g)![]() 2NO2£¨n(NO)ÀÊ ±º‰µƒ±‰ªØ»Áœ¬±ÌÀ˘ æ°£
2NO2£¨n(NO)ÀÊ ±º‰µƒ±‰ªØ»Áœ¬±ÌÀ˘ æ°£
±º‰®Ms | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)®Mmol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
£®1£©¥”0°´3sƒ⁄£¨”√NO±Ì 浃∆Ωæ˘∑¥”¶ÀŸ¬ ¶‘(NO)£Ω_____________°£
£®2£©Õº÷–±Ì æNO≈®∂»±‰ªØµƒ«˙œþ «_______(ÃÓ◊÷ƒ∏¥˙∫≈)°£
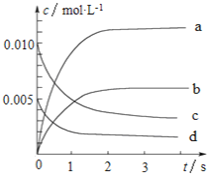
£®3£©¥Ô∆Ω∫‚ ±NOµƒ◊™ªØ¬ Œ™________°£
£®4£©ƒÐÀµ√˜∏√∑¥”¶“—¥ÔµΩ∆Ω∫‚◊¥Ã¨µƒ «_________(ÃÓ–Ú∫≈)°£
A£ÆªÏ∫œ∆¯Ãµƒ—’…´±£≥÷≤ª±‰
B£ÆªÏ∫œ∆¯Ãµƒ√Ð∂»±£≥÷≤ª±‰
C£Æ¶‘ƒÊ (NO2)£Ω2¶‘’˝ (O2)
D£ÆªÏ∫œ∆¯Ãµƒ∆Ωæ˘œý∂‘∑÷◊”÷ ¡ø±£≥÷≤ª±‰
£®5£©»Ù…˝Œ¬µΩ850°Ê£¨¥Ô∆Ω∫‚∫Ûn(NO)£Ωn(NO2)£¨‘Ú∑¥”¶œÚ________(ÃÓ°∞’˝∑¥”¶∑ΩœÚ°±°¢°∞ƒÊ∑¥”¶∑ΩœÚ°±)“∆∂Ø°£
£®6£©»Ù‘⁄“ª∂®Ãıº˛œ¬0.2molNO∆¯Ã”Ηı∆¯∑¥”¶£¨¥Ô∆Ω∫‚ ±≤‚µ√∑≈≥ˆµƒ»»¡øŒ™akJ£¨¥À ±NO◊™ªØ¬ Œ™80%£¨‘Ú2molNO∆¯ÃÂÕÍ»´∑¥”¶∑≈≥ˆµƒ»»¡øŒ™____________°£
°æƒø°øœ¬¡–ŒÔ÷ µƒ∑÷¿ý’˝»∑µƒ «£® £©
ºÓ | À· | —Œ | ºÓ–‘—ıªØŒÔ | À·–‘—ıªØŒÔ | |
A | Na2CO3 | H2SO4 | Cu2£®OH£©2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O2 | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A.AB.BC.CD.D