题目内容
【题目】下列图示与对应叙述相符的是
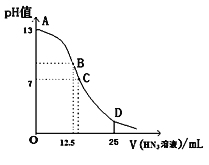
A.如图:常温下,0.1 mol ·L-1盐酸稀释时pH随加入水的体积变化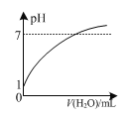
B.如图:铅蓄电池放电时,正极附近溶液的pH随时间的变化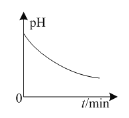
C.如图:不同压强下,可逆反应A(g)+B(g)![]() C(g)+D(s)中A的浓度随时间的变化
C(g)+D(s)中A的浓度随时间的变化
D.如图:镁条放入足量2 mol ·L-1盐酸中,生成氢气速率随时间的变化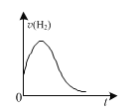
【答案】D
【解析】
A.盐酸溶液加水稀释后溶液始终显酸性,不可能显碱性,故A错误;
B.铅蓄电池放电时,正极发生的电极反应为PbO2+4H++SO42-=PbSO4↓+2H2O,则正极附近溶液的pH随时间的变化是逐渐增大,故B错误;
C.恒温条件下可逆反应A(g)+B(g)![]() C(g)+D(s)达到平衡后,增大压强平衡正向移动,则在两个不同压强下形成的平衡状态不同,A的平衡浓度也不同,故C错误;
C(g)+D(s)达到平衡后,增大压强平衡正向移动,则在两个不同压强下形成的平衡状态不同,A的平衡浓度也不同,故C错误;
D.镁条放入足量2 mol ·L-1盐酸中,开始时反应放热温度升高,则反应速率加快,随着反应进行浓度减小,则速率减小,故D正确;
故答案为D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)