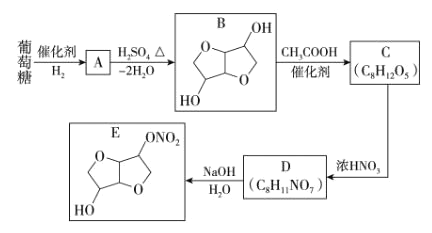
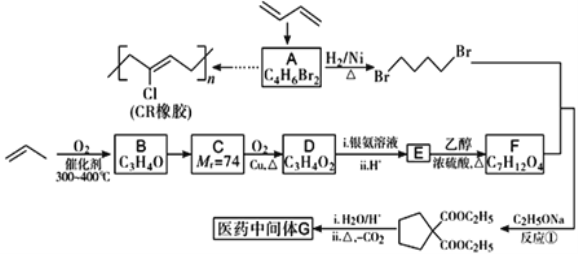
题目内容
【题目】现有下列8种物质:①液氯;②铜;③熔融NaHSO4;④Fe(OH)3固体; ⑤ 盐酸;⑥蔗糖;⑦干冰;⑧红磷固体;⑨ AgCl; ⑩CH3COOH晶体,请按要求回答下列问题(填写物质编号)。
(1) 上述状态下能导电的是_________________________;
(2) 属于电解质是______________;
(3) 属于非电解质的是_______________;
(4) 3.1 g红磷在氯气中充分反应后,生成三氯化磷与五氯化磷的物质的量之比为1:3 , 该反应的化学方程式为___________________;
(5) 写出④与⑤反应的离子方程式________________________;
(6) 写出往NaHSO4溶液中沛加Ba(OH)2溶液至溶液呈中性时的离子方程式________。
【答案】②③⑤ ③④⑨⑩ ⑥⑦ 4P + 9Cl2 = PCl3 + 3PCl5 Fe(OH)3+3H+=Fe3++3H2O Ba2++2OH-+2H++SO42- =BaSO4↓ +2H2O
【解析】
(1)②铜含有自由电子③熔融NaHSO4和⑤盐酸都含有自由移动的离子,三者能导电;故答案为:②③⑤;
(2)③熔融NaHSO4和⑨AgCl熔融状态下能完全电离,属于强电解质;④Fe(OH)3固体;⑩CH3COOH晶体只能部分电离产生自由移动的离子,属于弱电解质,所以属于电解质为:③④⑨⑩;
(3)⑥蔗糖;⑦干冰,本身都不能电离产生自由移动的离子,都是化合物,为非电解质;
故答案为:⑥⑦;
(4)3.1 g红磷的物质的量为:![]() ,在氯气中充分反应,生成三氯化磷与五氯化磷的物质的量之比为1:3,则该反应中氧化剂为氯气,氯元素由0价变为-1价,还原剂为P,化合价由0价变为+3价和+5价,且物质的量之比为1:3,根据电子守恒可知方程式为:4P + 9Cl2 = PCl3 + 3PCl5;
,在氯气中充分反应,生成三氯化磷与五氯化磷的物质的量之比为1:3,则该反应中氧化剂为氯气,氯元素由0价变为-1价,还原剂为P,化合价由0价变为+3价和+5价,且物质的量之比为1:3,根据电子守恒可知方程式为:4P + 9Cl2 = PCl3 + 3PCl5;
(5)氢氧化铁和盐酸反应生成氯化铁和水,离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
(6)NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,二者反应生成硫酸钡,硫酸钠和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;

 星级口算天天练系列答案
星级口算天天练系列答案【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示:
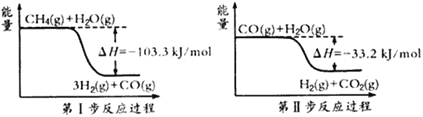
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___________________,反应消耗1mol NaBH4时转移的电子数目为_______。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
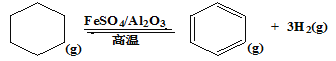
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=____________________(用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
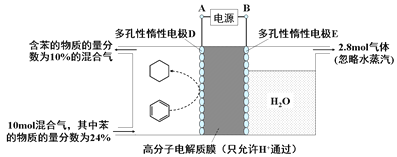
①实现有机物储氢的电极是________;
A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为:________________________。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是_________。由表中数据可知,此装置的电流效率η=______________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。