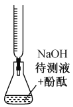
题目内容
【题目】已知 25℃时,向 0.1mo/L 的碳酸氢钠溶液滴几滴酚酞,呈微红色,则该溶液中
A.若滴加甲基橙溶液呈红色
B.c(HCO3-)>c(CO32-)>c(H2CO3)
C.c(OH-)=c(H+)+ c(H2CO3)- c(CO32-)
D.若加水稀释,![]() 的比值减小
的比值减小
【答案】C
【解析】
向 0.1mo/L 的碳酸氢钠溶液滴几滴酚酞,呈微红色,则溶液pH>7,以此解题。
A.甲基橙的变色范围为3.1-4.4,当pH大于4.4时,甲基橙为黄色,故A错误;
B.0.1mol/L的碳酸氢钠溶液的pH>7,说明碳酸氢根离子的水解程度大于电离程度,但电离程度和水解程度都较小,则c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),物料守恒式减去电荷守恒式得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故C正确;
D.加水稀释,促进碳酸氢根离子水解生成碳酸,因此碳酸氢根离子浓度减小,碳酸浓度增大,所以,![]() 的比值增大,故D错误;
的比值增大,故D错误;
答案选C。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目