��Ŀ����
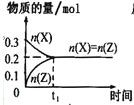
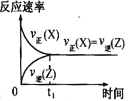
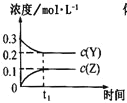
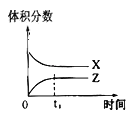
����Ŀ��������һ�������Դ������ʹ�����Ϊ�������õĹؼ��������ǵ�ǰ��ѧ����Ҫ��ע���ȵ����⡣��1���ü�����ȡ������������Ӧ�������仯����ͼ��ʾ��
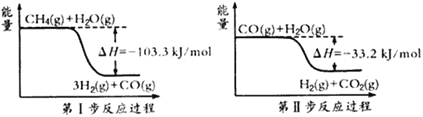
�ټ����ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��________________��
�ڵڢ�ӦΪ���淴Ӧ��800��ʱ����CO����ʼŨ��Ϊ2.0 mol��L��1��ˮ��������ʼŨ��Ϊ3.0 mol��L��1���ﵽ��ѧƽ��״̬���CO2��Ũ��Ϊ1.2 mol��L��1����CO��ƽ��ת����Ϊ__________��
��2��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��BԪ�صĻ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ___________________����Ӧ����1mol NaBH4ʱת�Ƶĵ�����ĿΪ_______��
��3������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⡣
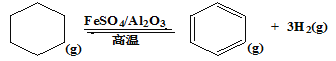
��ij�¶��£�����������м��뻷���飬����ʼŨ��Ϊa mol��L��1��ƽ��ʱ����Ũ��Ϊb mol��L��1���÷�Ӧ��ƽ�ⳣ��K=____________________���ú�a��b�Ĺ�ϵʽ�����
��4��һ�������£�����ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ���⣨��Ŀ������⣬������Ϊ�������л������ɣ���
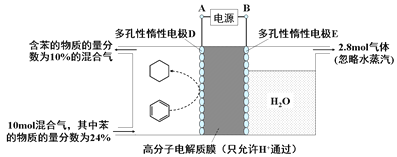
��ʵ���л��ﴢ��ĵ缫��________��
A������ | B������ | C������ | D������ |
��缫��Ӧ����Ϊ��________________________��
�ڸô���װ�õĵ���Ч��������С��100%������Ҫԭ������ص缫��Ŀ������⣬����һ�ֵ����������ɣ�����������_________���ɱ������ݿ�֪����װ�õĵ���Ч������______________��[����������Ŀ��������ĵĵ�����/ת�Ƶĵ�����������100%������������С�����1λ]��
���𰸡�CH4(g) + 2H2O(g) =4H2(g) +CO2(g); ��H = -136.5 kJ/mol 60% NaBH4��2H2O=NaBO2��4H2�� 4NA��2.408��1024 ![]() mol3��L��3 C C6H6��6H����6e����C6H12 H2 64.3%
mol3��L��3 C C6H6��6H����6e����C6H12 H2 64.3%
��������
��1���ٸ���ͼ��ɵü����ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��CH4(g) + 2H2O(g) =4H2(g) +CO2(g); ��H =" -136.5" kJ/mol ;�ڵڢ�ӦΪ���淴Ӧ������ͼ���д���÷�Ӧ�Ļ�ѧ����ʽΪ���ڢ�ӦΪ���淴Ӧ��CO(g) + H2O(g)= H2(g)+CO2(g) ��H =" -33.2" kJ/mol
��ʼŨ�ȣ�2.0 3.0 0 0
�仯Ũ�ȣ�1.2 1.2 1.2 1.2
ƽ��Ũ�ȣ�0.8 1.8 1.2 1.2 CO��ƽ��ת����Ϊ1.2/2.0x100%=60%
(2)��Ӧǰ��BԪ�صĻ��ϼ۲��䣬��Ӧǰ��BԪ�صĻ��ϼ۾��ǣ�3�ۣ���˷�ӦǰNaBH4����Ԫ�صĻ��ϼ��ǣ�1�ۡ�ˮ����Ԫ�صĻ��ϼ��ǣ�1�ۣ���˷�Ӧ�л����������ɣ���Ӧ�Ļ�ѧ����ʽΪNaBH4��2H2O=NaBO2��4H2����NaBH4����Ԫ�صĻ��ϼ۴ӣ�1�����ߵ�0�ۣ����1molNaBH4�ڷ�Ӧ��ʧȥ4mol���ӣ�����Ŀ��4NA��2.408��1024��
(3)ƽ��ʱ����Ũ����b mol/L������ݷ�Ӧ�ķ���ʽ��֪���Ļ������Ũ����b mol/L������������Ũ����3 b mol/L����ƽ��ʱ�������Ũ��Ϊ��a��b��mol/L�����ڻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ������¶��·�Ӧ��ƽ�ⳣ��Ϊ![]() ��
��![]() mol3/L3��
mol3/L3��
��4���ٱ����ɻ��������ڵ��ⷴӦ�����ʵ���л��ﴢ��ĵ缫�����������õ��������ɻ�������Ŀ�������ڴ������ӽ���Ĥ�������������������ƶ�����缫��ӦʽΪC6H6��6H����6e����C6H12��
����������Ŀ���������ܷ��������ӵõ������������ĵ缫��Ӧ������������������������������2.8mol���壬������Ӧ��������OH���ŵ����ɵ���������ת�Ƶ��ӵ����ʵ�����2.8mol��4��11.2mol�����������ı������ʵ�����xmol����ͬʱ���� xmol�����飬���ݵ缫��ӦʽC6H6��6H����6e����C6H12��֪�õ�������6xmol�����ݵ����غ��֪����������������![]() ��5.6mol��3xmol������
��5.6mol��3xmol������![]() ��0.1�����x��1.2����˴���װ�õĵ���Ч�ʣ�
��0.1�����x��1.2����˴���װ�õĵ���Ч�ʣ�![]() ��100%��64.3%��
��100%��64.3%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�