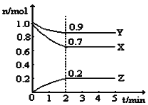
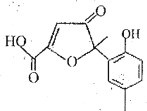
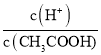题目内容
【题目】某同学为探究MnO2与浓盐酸的反应,用如图所示的装置进行实验。
(1)B是用来收集气体的装置,但未将导管画全,请在装置图中将导管补画完整。_________
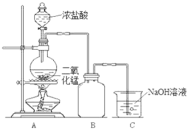
(2)制备实验开始时,先检查装置气密性,接下来的操作依次是_________(填字母)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中滴加浓盐酸
(3)实验中该同学取8.7g MnO2和50mL 12mol/L浓盐酸在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有固体剩余,该同学还检测到有一定量的盐酸剩余。
①MnO2与浓盐酸反应的化学方程式为_________。
②为什么有一定量的盐酸剩余但未能使MnO2完全溶解?_________。
③下列试剂中,能证明反应停止后烧瓶中有盐酸剩余的是_________(填字母)。
A.硝酸银溶液 B.碳酸钠溶液 C.氯化钠溶液
(4)为了测定反应残余液中盐酸的浓度,该同学设计了两个实验方案:
方案一:将A中产生的气体缓缓通过已称量的装有足量NaOH溶液的洗气瓶,反应停止后再次称量,两次质量差即是Cl2的质量,据此可求剩余盐酸的量。
方案二:当MnO2与浓盐酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生H2的体积为V L(已换算为标准状况下)。
①实际上方案一不合理,原因为_________。
②根据方案二,写出剩余盐酸的物质的量浓度的计算式(假设反应前后溶液的体积保持不变)_________。
【答案】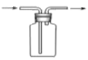 ACB MnO2+4HCl(浓)
ACB MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O MnO2只与浓盐酸反应,浓盐酸随反应进行会变稀 B NaOH溶液不仅吸收Cl2,还吸收挥发出的HCl和H2O
MnCl2+Cl2↑+2H2O MnO2只与浓盐酸反应,浓盐酸随反应进行会变稀 B NaOH溶液不仅吸收Cl2,还吸收挥发出的HCl和H2O 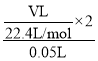
【解析】
实验室用MnO2与浓盐酸在加热条件下反应制取Cl2,发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由于浓盐酸易挥发,所以需控制加热温度,否则盐酸大量挥发,不仅降低反应物的转化率,还会使Cl2中混入过多的HCl和水蒸气;由于稀盐酸与MnO2不反应,所以盐酸、MnO2都有剩余;由于Cl2的密度比空气大,所以应采用长进短出的方法收集Cl2;Cl2有毒,会污染环境,需使用尾气处理装置。
MnCl2+Cl2↑+2H2O,由于浓盐酸易挥发,所以需控制加热温度,否则盐酸大量挥发,不仅降低反应物的转化率,还会使Cl2中混入过多的HCl和水蒸气;由于稀盐酸与MnO2不反应,所以盐酸、MnO2都有剩余;由于Cl2的密度比空气大,所以应采用长进短出的方法收集Cl2;Cl2有毒,会污染环境,需使用尾气处理装置。
(1)由上面分析知,收集Cl2,集气瓶内导管应长进短出,装置图为 ;
;
(2)制备实验开始时,先检查装置气密性,然后往烧瓶内加MnO2固体,再往烧瓶内滴加浓盐酸,最后给烧瓶加热,故选ACB;
(3)①MnO2与浓盐酸反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②因为稀盐酸与MnO2不反应,所以虽然有盐酸剩余,但未能使MnO2完全溶解,原因是MnO2只与浓盐酸反应,浓盐酸随反应进行会变稀;
③因为反应后溶液中含有MnCl2电离产生的Cl-,所以能证明反应停止后烧瓶中有盐酸剩余的试剂是能与盐酸电离出H+反应的试剂碳酸钠溶液,故选B;
(4)①方案一中,Cl2中混入浓盐酸挥发出的HCl和水蒸气,所以不合理,原因为NaOH溶液不仅吸收Cl2,还吸收挥发出的HCl和H2O;
②根据方案二,发生反应Zn+2HCl==ZnCl2+H2↑,剩余盐酸的物质的量浓度为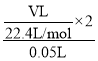 。
。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。

(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
【题目】部分短周期元素的性质或原子结构等信息如下表:
元素编号 | 元素性质或原子结构信息 |
X | 元素最高正价是+7价 |
Y | M层的电子数是K层的3倍 |
Z | 最外层电子数是次外层电子数的2倍 |
W | 单质是双原子分子,其氢化物水溶液呈碱性 |
(1)写出X在元素周期表中的位置_________。
(2)写出实验室制取W的气态氢化物的化学方程式_________。
(3)Z的一种核素可测定文物年代,其中子数比质子数多2,这种核素的符号是_________。
(4)W的气态氢化物与最高价氧化物对应水化物形成的盐中存在的化学键类型为_________。
(5)W元素与氢元素按原子数目比1:3和2:4构成分子A和B,A的电子式为_________,B的结构式为__________。
(6)X与Y相比,非金属性较强的是_______(填元素符号),下列能证实这一事实的是_________
a.单质X沸点比单质Y的低
b.X的氢化物比Y的氢化物稳定
c.单质X能与水反应,而单质Y不能与水反应