题目内容
【题目】某有机物是一种医药中间体。其结构简式如图所示,下列有关该物质的说法正确的是
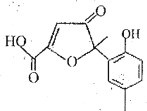
A.该化合物分子中只含一个手性碳原子
B.该化合物与NaHCO3溶液作用有CO2气体放出
C.1mol该化合物与足量溴水反应,消耗3molBr2
D.在一定条件下,该化合物与HCHO能发生缩聚反应
【答案】AB
【解析】
A.当一个碳原子,连接4个不同的原子或原子团,该碳原子为手性碳原子,分子中只有1个手性碳原子,如图所示,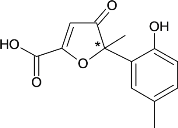 ,A正确;
,A正确;
B.分子中有1个羧基,具有酸性,可以与NaHCO3反应放出CO2气体,B正确;
C.碳碳双键可以与Br2发生加成,酚羟基的邻、对位上的H可以被-Br取代,1mol该分子含有1mol碳碳双键,与1molBr2发生加成,酚羟基只有1个邻位可以被取代,消耗1molBr2.则共消耗2molBr2,C错误;
D.羟基邻位只有1个H原子,与甲醛不能发生缩聚反应,故D错误。
答案选AB。

 阅读快车系列答案
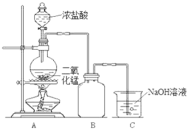
阅读快车系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
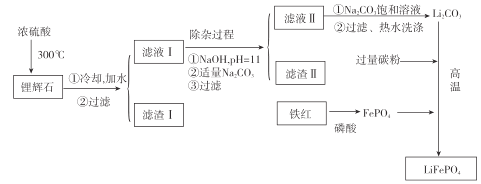
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。