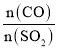题目内容
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。

(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
【答案】3d24s2 O>Cl>C 三种物质都是分子晶体,组成和结构相似时,相对分子质量越大,分子间作用力越大,熔沸点越高 [Ti(H2O)6]Cl3 CaTiO3 (正)八面体 4.0 g/cm3
【解析】
(1)Ti位于周期表中第4周期第ⅣB族;元素的非金属性越强其电负性越强;
(2)三种钛的卤化物均为分子晶体,结构相似,相对分子质量越大,熔沸点越高;
(3)配合物外界能够完全电离,根据与AgNO3发生反应的物质的量之比确定配合物的化学式;
(4)根据晶胞结构,顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,内部粒子为整个晶胞所有,据此推测化学式;根据晶胞结构示意图推断Ca原子的位置;
,内部粒子为整个晶胞所有,据此推测化学式;根据晶胞结构示意图推断Ca原子的位置;
(5)根据密度ρ=![]() 做相关计算。
做相关计算。
(1)Ti位于周期表中第4周期第ⅣB族,所以钛的价层电子排布式为3d24s2;元素的非金属性越强其电负性越强,故上述反应中非金属元素电负性由大到小是O>Cl>C;
(2)三种钛的卤化物均为分子晶体,结构相似,相对分子质量越大,分子间作用力越强,熔沸点越高;
(3)配合物外界能够完全电离,Y与AgNO3以1:3物质的量比反应生成沉淀,所以Y的外界能够解离出3份Cl,则Y的化学式为[Ti(H2O)6]Cl3;
(4)根据晶胞结构,顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,内部粒子为整个晶胞所有,所以一个晶胞中有Ti为8×
,内部粒子为整个晶胞所有,所以一个晶胞中有Ti为8×![]() =1个,有Ca为1个,有O为6×
=1个,有Ca为1个,有O为6×![]() =3个,所以Z的化学式为CaTiO3,根据晶胞结构示意图可知Ca填充在O围成的正八面体空隙中;
=3个,所以Z的化学式为CaTiO3,根据晶胞结构示意图可知Ca填充在O围成的正八面体空隙中;
(5)不妨设有1mol这样的晶胞,即有NA个这样的晶胞,1个晶胞的体积为V=a3pm3=a3×1030cm3,1mol晶胞的质量为m=1mol×136g/mol=136g,所以晶体密度为ρ=![]() =
=![]() g/cm3=
g/cm3=![]() g/cm3=4.0g/cm3。
g/cm3=4.0g/cm3。

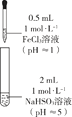
【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
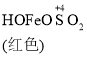
![]()
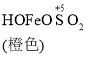
![]() Fe2++SO42-
Fe2++SO42-
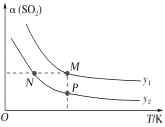
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象
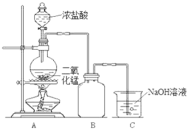
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |