题目内容
14.现有KCl和KBr的混合物3.87g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为( )| A. | 24.1% | B. | 25.9% | C. | 40.3% | D. | 48.1% |
分析 该反应中 K+被Ag+取代生成AgX沉淀,利用差量法计算钾离子物质的量,再根据m=nM计算钾离子质量,根据质量分数公式计算K元素质量分数即可.
解答 解:从KX、AgX可认为1 mol K+被1 mol Ag+取代.
设钾离子的物质的量为n,
根据差量法:
KX-AgX△m
1 mol 69 g
n(K+) (6.63-3.87)g
故n(K+)=$\frac{1mol×(6.63-3.87)g}{69g}$mol=0.04 mol
故m(K+)=39 g•mol-1×0.04 mol=1.56 g
w(K+)=$\frac{1.56g}{3.87g}$×100%=40.3%,
故选C.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,明确固体质量增加量含义是解本题关键,利用差量法分析解答,题目难度不大.

练习册系列答案
相关题目
4.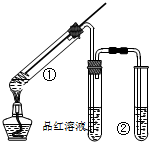 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
5.下列叙述错误的是( )
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
2.有机物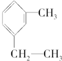 用系统命名法命名为( )
用系统命名法命名为( )
 用系统命名法命名为( )
用系统命名法命名为( )| A. | 间甲乙苯 | B. | 1,3-甲乙苯 | ||
| C. | 1-甲基-3-乙基苯 | D. | 1-甲基--5-乙基苯 |
9.下列“反应”中不是化学反应的是( )
| A. | 显色反应 | B. | 焰色反应 | C. | 颜色反应 | D. | 水解反应 |
19.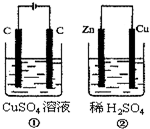 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )| A. | 右边电极上生成物质的物质的量:①=② | |
| B. | 相同状态下电极上产生气体的体积:①=② | |
| C. | 溶液的pH变化:①减小,②增大 | |
| D. | 电极反应式①中阴极Cu2++2e-═Cu:②中负极:Zn-2e-═Zn2+ |
3.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液( )
| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |
4.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
请回答:
(1)X2Z的电子式是 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.
(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
| 元素 | 有关信息 |
| X | 在元素周期表中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要合价为一2价 |
| M | 其单质及化合物的焰色反应呈黄色 |
| N | 与Y同主族,其单质为半导体 |
(1)X2Z的电子式是
 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
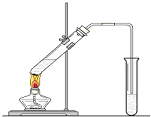 如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象.
如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.