题目内容
6.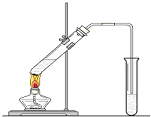 如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象.
如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象.(1)在试管中加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加B.冷却后补加C.不需补加 D.重新配料
(2)导管能否伸到液面以下不能(用“能”或“不能”填空),
(3)请写出该反应的化学反应方程式:CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
分析 (1)液体加热要加碎瓷片,防止暴沸;如果加热一段时间后发现忘记加碎瓷片,应冷却至室温,补加碎瓷片;
(2)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应.
解答 解:(1)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加瓷片,如果加热一段时间后发现忘记加碎瓷片,防止冷热不均,应冷却至室温,补加碎瓷片,
故答案为:防止暴沸;B;
(2)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,导管不能插入到Na2CO3溶液中,防止倒吸回流现象的发生,
故答案为:不能;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
点评 本题考查了乙酸乙酯的制备,注意把握乙酸乙酯的制备原理和实验方法以及乙酸乙酯与乙酸、乙醇性质是解答关键,题目难度不大.

练习册系列答案
相关题目
16.下列有关晶体的叙述中不正确的是( )
| A. | 在晶体中只要有阴离子就一定有阳离子 | |
| B. | 1mol SiO2晶体中含2mol Si-O键 | |
| C. | 干冰晶体中每个CO2分子周围紧邻12个CO2分子 | |
| D. | 金刚石晶体中的最小环由6个碳原子构成 |
14.现有KCl和KBr的混合物3.87g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为( )
| A. | 24.1% | B. | 25.9% | C. | 40.3% | D. | 48.1% |
11.E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)?G(g),已知该反应的平衡常数值如下表所示.下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,F的体积百分含量将增大 |
15.已知某强氧化剂RO(OH)2+ 中的R元素被Na2SO3还原到低价态.如果还原2.4×10-3mol RO(OH)2+ 至较低价态,需要60 mL 0.1 mol/L的Na2SO3溶液.那么,R元素被还原成的价态是( )
| A. | -1 | B. | 0 | C. | +1 | D. | +2 |
16.下列有关化学与自然资源的开发利用说法中不正确的是( )
| A. | 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴 | |
| B. | 石油裂化的主要目的是提高汽油的产量 | |
| C. | 煤干馏的产品很多,是一个化学变化 | |
| D. | 海水提镁的过程为:MgCl2(aq)$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{煅烧}{→}$MgO$\stackrel{电解}{→}$Mg |
 (1)试回答下列中学化学实验中常见仪器的有关问题:在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同)⑤⑧;标有使用温度的仪器是⑤⑥⑦.用到“磨砂”处理的有①②③④⑤⑥.
(1)试回答下列中学化学实验中常见仪器的有关问题:在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同)⑤⑧;标有使用温度的仪器是⑤⑥⑦.用到“磨砂”处理的有①②③④⑤⑥. .
.