题目内容
19.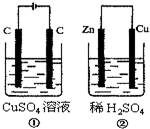 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )| A. | 右边电极上生成物质的物质的量:①=② | |
| B. | 相同状态下电极上产生气体的体积:①=② | |
| C. | 溶液的pH变化:①减小,②增大 | |
| D. | 电极反应式①中阴极Cu2++2e-═Cu:②中负极:Zn-2e-═Zn2+ |
分析 ①有外接电源,所以是电解池,阳极反应为4OH--4e-=O2↑+2H2O,阴极反应为:Cu2++2e-=Cu,②为原电池,正极反应为2H++2e-=H2↑,负极反应为Zn-2e-=Zn2+,以此解答该题.
解答 解:A、①右边电极阴极生成铜,反应为:Cu2++2e-=Cu;②右边电极为正极生成氢气,反应为2H++2e-=H2↑,则导线中均通过0.01mol电子,所以电极上析出物质的物质的量:①=②,故A正确;
B、①的阳极反应:4OH--4e-=O2↑+2H2O,导线中通过0.01mol电子时,产生氧气的体积V=nVm=0.01mol×$\frac{1}{4}$×22.4L/mol=0.0056L,②中的正极反应为:2H++2e-=H2↑,导线中通过0.01mol电子时,产生氢气的体积V=nVm=0.01mol×$\frac{1}{2}$×22.4L/mol=0.0112L,所以产生气体的体积:①≠②,故B错误;
C、①相当于电解硫酸铜,溶液的pH减小,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故C正确;
D、①中阴极反应为:Cu2++2e-=Cu,②中的负极:Zn-2e-═Zn2+,故D正确.
故选B.
点评 本题是一道有关原电池和电解池的工作原理的综合题目,要求学生熟悉教材基本知识,具备分析和解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列物质的提纯或离子检验的方法正确的是( )
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | 以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜 | |
| C. | 除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可 | |
| D. | 加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32- |
7.下列关于同温同压下,同质量气体H2、D2、T2的叙述中,正确的是( )
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ③④ |
14.现有KCl和KBr的混合物3.87g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为( )
| A. | 24.1% | B. | 25.9% | C. | 40.3% | D. | 48.1% |
4.金属钠应该保存在( )
| A. | 水中 | B. | 乙酸中 | C. | 煤油中 | D. | 乙醇中 |
11.E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)?G(g),已知该反应的平衡常数值如下表所示.下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,F的体积百分含量将增大 |
9.下列物质之间的相互关系错误的是( )
| A. | H和D互为同位素 | B. |  与 与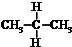 互为同分异构体 互为同分异构体 | ||
| C. | CH3CH3和CH3CH2CH3互为同系物 | D. | O2和O3互为同素异形体 |
 消去反应
消去反应 取代反应
取代反应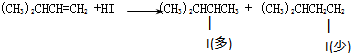 加成反应
加成反应 取代反应
取代反应