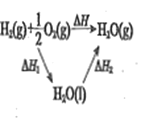题目内容
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
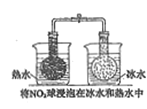
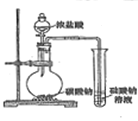
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
【答案】B
【解析】
A.2NO2(g)![]() N2O4(g)△H<0,为放热反应,结合温度对化学平衡的影响分析;
N2O4(g)△H<0,为放热反应,结合温度对化学平衡的影响分析;
B.HCl不是含氧酸,盐酸酸性大于碳酸与元素周期律无关,应用高氯酸;
C.根据盖斯定律分析;
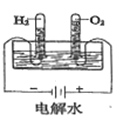
D.根据电子守恒计算生成氢气和氧气的物质的量,然后利用阿伏伽德罗定律分析。
A.2NO2(g)![]() N2O4(g)△H<0,为放热反应,热水中平衡向着逆向移动,二氧化氮浓度增大,左球气体颜色加深;冷水中平衡向着正向移动,二氧化氮浓度减小,右球气体颜色变浅,能够用勒夏特列原理解释,故A不选;
N2O4(g)△H<0,为放热反应,热水中平衡向着逆向移动,二氧化氮浓度增大,左球气体颜色加深;冷水中平衡向着正向移动,二氧化氮浓度减小,右球气体颜色变浅,能够用勒夏特列原理解释,故A不选;
B.烧瓶中冒气泡,证明酸性:HCl>碳酸,由于HCl不是含氧酸,无法用元素周期律解释,应用高氯酸,故B选;
C.根据盖斯定律:△H=△H1+△H2,能够用盖斯定律解释,故C不选;
D.根据电子守恒可知,电解水生成H2与O2的物质的量之比2:1,结合阿伏伽德罗定律可知,H2与O2的体积比约为2:1,故D不选;
故选:B。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目