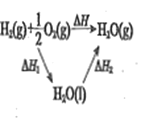题目内容
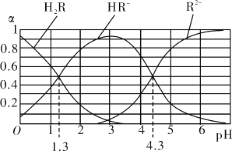
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,KHC2O4溶液显酸性。现称取5.0g含H2C2O42H2O、KHC2O4和K2SO4的固体样品,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.2500mol/LNaOH溶液,滴定终点时消耗NaOH溶液16.00mL。第二份溶液用0.1000mol/L酸性KMnO4溶液滴定,当加入12.00mL酸性KMnO4溶液时恰好反应完全。
(1)K2C2O4溶液呈碱性的原因(用离子方程式表示)_______________________________。
(2)在该实验中不需要用到的实验仪器有___________(填字母编号)。
A.容量瓶 B.酸式滴定管 C.碱式滴定管 D.分液漏斗 E.锥形瓶 F.圆底烧瓶
(3)第一份用NaOH溶液滴定时,滴定终点的判断依据为____________________________________。
(4)原试样中KHC2O4的质量分数为__________%(保留3位有效数字)。
(5)如果用0.2500mol/LNaOH溶液滴定第一份溶液的实验中,在滴定终点时俯视读数。则测得的KHC2O4的质量分数_________(填“偏高”、“偏低”或“无影响”)。
【答案】C2O42—+H2O![]() HC2O4—+OH— D、F 当滴入一滴NaOH溶液时,溶液颜色恰好由无色到粉(浅)红色且半分钟内不褪色,即达到滴定终点 51.2 偏高
HC2O4—+OH— D、F 当滴入一滴NaOH溶液时,溶液颜色恰好由无色到粉(浅)红色且半分钟内不褪色,即达到滴定终点 51.2 偏高
【解析】
H2C2O42H2O、KHC2O4和K2SO4的固体样品,配成溶液。分别用NaOH溶液和酸性KMnO4溶液滴定,在用NaOH溶液滴定过程中,1molH2C2O4 消耗2mol NaOH,1mol KHC2O4消耗1mol NaOH,在用酸性KMnO4溶液滴定过程中,2mol MnO4-消耗5mol C2O42-,据此分析;
(1)K2C2O4属于强碱弱酸盐,溶液呈碱性的原因为: C2O42—+H2O![]() HC2O4—+OH— ;
HC2O4—+OH— ;
(2)配制溶液过程中需要容量瓶,滴定过程中需要酸式滴定管、碱式滴定管、锥形瓶,故不需要用到的实验仪器有D、F;
(3)溶液显酸性,用NaOH溶液滴定时,滴定终点的判断依据为当滴入一滴NaOH溶液时,溶液颜色恰好由无色到粉(浅)红色且半分钟内不褪色,即达到滴定终点;
(4)由得失电子守恒可知2MnO4- ~ 5C2O42-
12×10-3×0.1mol 3×10-3mol
设滴定前溶液中含有H2C2O4 x mol、 KHC2O4 y mol。向溶液中加入NaOH时
H2C2O4 ~ 2NaOH
x mol 2x mol
HC2O4- ~NaOH
y mol y mol
由题意可知2x+y=16×10-3×0.25,x+y=3×10-3,解得x=1×10-3mol ,y=2×10-3mol,则固体样品中m( KHC2O4)= 2×10-3×128=0.256g,KHC2O4的质量分数=0.256/0.5×100%=51.2%
(5)用NaOH溶液滴定过程中,在滴定终点时俯视读数,使消耗NaOH的体积偏小,即2x+y偏小,x+y不变,则KHC2O4的质量分数偏高;

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
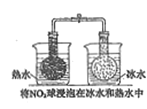
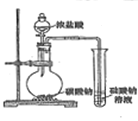
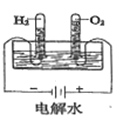
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D