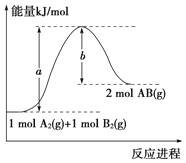
题目内容
【题目】![]() ,改变
,改变![]() 溶液的
溶液的![]() ,溶液中
,溶液中![]() 浓度的对数值
浓度的对数值![]() 与溶液
与溶液![]() 的变化关系如图所示。若
的变化关系如图所示。若![]() 。下列叙述错误的是( )
。下列叙述错误的是( )

A. ![]() 时,
时,![]()
B. ![]() 电离常数的数量级为
电离常数的数量级为![]()
C. 图中点x的纵坐标值为![]()
D. ![]() 的
的![]() 约等于线c与线d交点处的横坐标值
约等于线c与线d交点处的横坐标值
【答案】A
【解析】
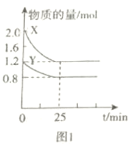
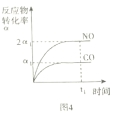
根据图知,pH<7时,CH3COOH电离量少,c表示CH3COOH的浓度;pH=7时c(OH-)=c(H+),二者的对数相等,且pH越大c(OH-)越大、c(H+)越小,则lgc(OH-)增大,所以b、d分别表示H+、OH-;pH>7时,CH3COOH几乎以CH3COO-形式存在,a表示CH3COO-;
A、pH=6时,纵坐标越大,该微粒浓度越大;
B、c(CH3COOH)=c(CH3COO-)时,CH3COOH电离平衡常数K=c(H+)·c(CH3COO-)/c(CH3COOH)=c(H+);
C、根据K=c(H+)·c(CH3COO-)/c(CH3COOH)求解;
D、CH3COO-+H2O![]() CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,求出c(OH-),pH=14-pOH,即c与线d交点处的横坐标值。
CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,求出c(OH-),pH=14-pOH,即c与线d交点处的横坐标值。
A、pH=6时,纵坐标越大,该微粒浓度越大,所以存在c(CH3COO-)>c(CH3COOH)>c(H+),故A错误;
B、c(CH3COOH)=c(CH3COO-)时,CH3COOH电离平衡常数K=c(H+)·c(CH3COO-)/c(CH3COOH)=c(H+)=10-4.74,故B正确;
C、根据K=c(H+)·c(CH3COO-)/c(CH3COOH)求解;pH=2时,c(H+)=10-2mol·L-1,从曲线c读出c(CH3COOH)=10-2mol·L-1,由选项B,K=10-4.74,解得c(CH3COO-)=10-4.74,故C正确;
D、CH3COO-+H2O![]() CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,从c与线d交点作垂线,交点 c(HAc)=c(Ac-),求出c(OH-)=1/k=104.74mol·L-1,pH=14-pOH=9.26,即c与线d交点处的横坐标值。故D正确。
CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,从c与线d交点作垂线,交点 c(HAc)=c(Ac-),求出c(OH-)=1/k=104.74mol·L-1,pH=14-pOH=9.26,即c与线d交点处的横坐标值。故D正确。
故选A。

【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
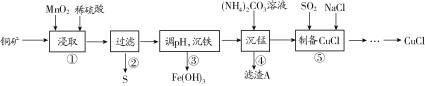
【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。