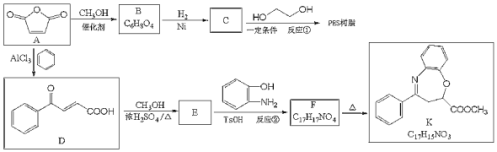
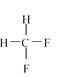
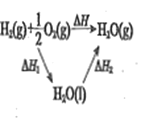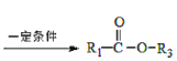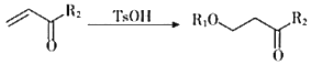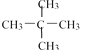题目内容
【题目】为了探究某固体化合物X(仅含3种元素,相对分子质量小于200)的组成和性质,设计并完成如下实验,其中X、A、B、C、D均为常见化合物。

请回答:
(1)黄色溶液中的金属阳离子是________。
(2)固体A→白色沉淀B的离子方程式是______________________________。
(3)X的化学式是_____________________________________。
【答案】Fe3+ SO3+Ba2++ H2O=BaSO4↓+2H+ FeSO4
【解析】
由黄色溶液中加入KSCN溶液,溶液变为血红色可知,黄色溶液为氯化铁溶液,则D为氧化铁;由气体C能使品红溶液褪色可知,C为二氧化硫,固体A与氯化钡溶液反应生成白色沉淀B,说明A为三氧化硫、B为硫酸钡;由质量守恒定律可知m(A)=30.4g-
(16.0g+0.1mol×64g/mol)=8.0g,则n(Fe2O3)= 0.1mol ,n(SO2)= 0.1mol ,n(SO3)=0.1mol,由铁原子、氧原子和硫原子个数守恒可知X中n(Fe):n(S):n(O)=0.2:0.2:(0.3+0.2+0.3)
=1:1:4,X为硫酸亚铁。
(1)黄色溶液为氯化铁溶液,溶液中的金属阳离子是Fe3+,故答案为:Fe3+;
(2)固体A→白色沉淀B的反应为三氧化硫与氯化钡溶液反应生成硫酸钡白色沉淀,反应的离子方程式是SO3+Ba2++ H2O=BaSO4↓+2H+,故答案为:SO3+Ba2++ H2O=BaSO4↓+2H+;
(3)由质量守恒定律可知m(A)=30.4g-(16.0g+0.1mol×64g/mol)=8.0g,则n(Fe2O3)= 0.1mol ,n(SO2)= 0.1mol ,n(SO3)=0.1mol,由铁原子、氧原子和硫原子个数守恒可知X中n(Fe):n(S):n(O)=0.2:0.2:(0.3+0.2+0.3)=1:1:4,X为硫酸亚铁,故答案为:FeSO4。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
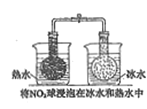
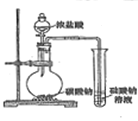
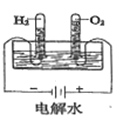
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
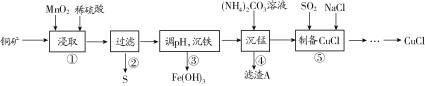
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。