题目内容
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
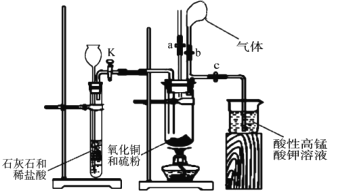
实验装置:(如图所示)

(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
【答案】分液漏斗 K1 K2、K3, Cr2O72+4Zn+14H+=2Cr2++4Zn2++7H2O K3 K1 溶液被压入锥形瓶 2Cr2++4CH3COO+2H2O=[Cr(CH3COO)2]22H2O↓ ![]() ×100% 低
×100% 低
【解析】
(1)根据图示仪器A的构造判断其名称;
(2)根据实验现象“抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡”可知,发生反应为Cr2O72+4Zn+14H+=2Cr2++4Zn2++7H2O、Zn+2H+=Zn2++H2↑,则需要将分液漏斗中盐酸放入锥形瓶,据此判断操作方法;根据反应“Zn+2H+=Zn2++H2↑”可知,该操作目的是利用氢气将生成的铬离子压入盛有醋酸钠溶液的锥形瓶;醋酸亚铬难溶于水,当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却,Cr2+和CH3COO反应生成[Cr(CH3COO)2]22H2O↓,据此书写离子方程式;
(3)根据铬离子守恒可得关系式:
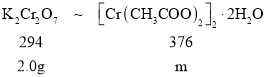
据此计算出理论上应该生成[Cr(CH3COO)2]22H2O的质量为,而实际上生成[Cr(CH3COO)2]22H2O的质量为1.0g,从而可计算其产率;实验过程中若盐酸过量,盐酸与锌发生反应,无法保证锌将Cr2O72完全转化成Cr2+。
(1)根据图示可知,仪器A为分液漏斗;
(2)根据实验现象“抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡”可知,发生反应为:Cr2O72+4Zn+14H+=2Cr2++4Zn2++7H2O、Zn+2H+=Zn2++H2↑,则需要将分液漏斗中盐酸放入锥形瓶,操作方法为:关闭①K1,打开②K2、K3,使盐酸缓慢加入至抽滤瓶中;
根据反应“Zn+2H+=Zn2++H2↑”可知,该操作目的是利用氢气将生成的铬离子压入盛有醋酸钠溶液的锥形瓶,需要关闭K2和④K3,打开⑤K1;
醋酸亚铬难溶于水,当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却,发生反应2Cr2++4CH3COO+2H2O=[Cr(CH3COO)2]22H2O↓,锥形瓶中有深红色[Cr(CH3COO)2]22H2O晶体析出;
(3)根据铬离子守恒可得关系式:
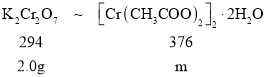
则理论上应该生成[Cr(CH3COO)2]22H2O的质量为:m=![]() g,而实际上生成[Cr(CH3COO)2]22H2O的质量为1.0g,则其产率为:=
g,而实际上生成[Cr(CH3COO)2]22H2O的质量为1.0g,则其产率为:=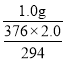 ×100%=
×100%=![]() ×100%;若盐酸过量,盐酸与锌发生反应,不能保证锌将Cr2O72完全转化成Cr2+,导致产率偏低。
×100%;若盐酸过量,盐酸与锌发生反应,不能保证锌将Cr2O72完全转化成Cr2+,导致产率偏低。

【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
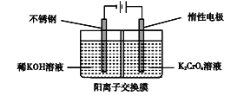
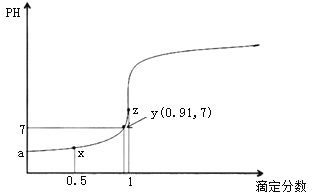
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
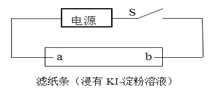
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。