题目内容
【题目】为探究氧化铜与硫的反应并分析反应后的固体产物,设计如下实验装置。
(1)如图连接实验装置,并_____。
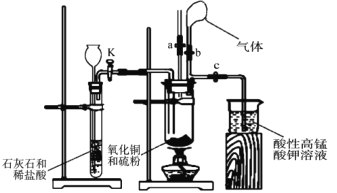
(2)将氧化铜粉末与硫粉按 5:1 质量比混合均匀。
(3)取适量氧化铜与硫粉的混合物装入大试管中,固定在铁架台上,打开_____ 和止水夹 a 并______,向长颈漏斗中加入稀盐酸,一段时间后,将燃着的木条放在止水夹 a 的上端导管口处,观察到木条熄灭,关闭活塞 K 和止水夹 a,打开止水夹 b。该实验步骤的作用是______,石灰石与稀盐酸反应的离子方程式为___________________。
(4)点燃酒精灯,预热大试管,然后对准大试管底部集中加热,一段时间后,气球膨胀, 移除酒精灯,反应继续进行。待反应结束,发现气球没有变小,打开止水夹 c,观察到酸性高锰酸钾溶液褪色后,立即用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞 K。这样操作的目的是__________________。
(5)拆下装置,发现黑色粉末混有砖红色粉末。取少量固体产物投入足量氨水中,得到无色溶液、但仍有红黑色固体未溶解,且该无色溶液在空气中逐渐变为蓝色。查阅资料得知溶液颜色变化是因为发生了以下反应:4[Cu(NH3)2]+ + O2+8NH3 H2O=4[Cu(NH3)4]2++4OH-+6H2O。
①经分析,固体产物中含有Cu2O。Cu2O 溶于氨水反应的离子方程式为______。
②仍有红色固体未溶解,表明氧化铜与硫除发生反应 4CuO + S![]() 2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
③进一步分析发现 CuO 已完全反应,不溶于氨水的黑色固体可能是_____(填化学式)。
【答案】检查装置气密性 活塞K 关闭 b、c 排除装置中的空气或氧气 CaCO3 +2H+ =Ca2++ H2O+CO2↑ 避免SO2污染空气 Cu2O+4NH3 · H2O =2[Cu(NH3)2]++2OH-+3H2O 2CuO+S![]() 2Cu+SO2 Cu2S
2Cu+SO2 Cu2S
【解析】
(1)硫在加热条件下易于空气中的氧气反应,对该实验会产生影响,要确保实验装置中无空气,保证密闭环境;
(3)氧化铜与硫的反应,需在无氧条件下进行,石灰石与盐酸反应产生的CO2气体排除装置中的空气;
(4)酸性高锰酸钾溶液褪色,说明产物有SO2,二氧化硫有毒不能排放到大气中;
(5)反应剩余固体含有Cu2O(砖红色),加入氨水后但仍有红黑色固体未溶解,表明有Cu,CuO与S的质量比为5∶1。而生成Cu2O的反应方程式为4CuO+ S![]() 2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量。
2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量。
(1)探究氧化铜与硫的反应,需在无氧条件下进行(S在空气与O2反应),故需对装置进行气密性检查;
(3)利用石灰石与盐酸反应产生的CO2气体排除装置中的空气,打开K使盐酸与石灰石接触,打开a,并检验是否排尽空气,该实验步骤的作用是排除装置中的空气或氧气。石灰石与盐酸反应的离子方程式是CaCO3+2H+=Ca2++ H2O+CO2↑;
(4)酸性高锰酸钾溶液褪色,说明产物有SO2,用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞K的目的是尽量使SO2被吸收,避免污染环境;
(5)结合题意,反应剩余固体含有Cu2O(砖红色),因为Cu2O与氨水反应为Cu2O+4NH3·H2O=2[Cu(NH3)2]+(无色)+2OH-+ 3H2O,4[Cu(NH3)2]++O2+8NH3·H2O=4 [Cu(NH3)4]2+(蓝色)+4OH-+6H2O。但仍有红黑色固体未溶解,表明有Cu,反应方程式为2CuO+S![]() 2Cu+SO2,其中CuO与S的质量比为5∶1。而生成Cu2O的反应方程式为4CuO+ S
2Cu+SO2,其中CuO与S的质量比为5∶1。而生成Cu2O的反应方程式为4CuO+ S![]() 2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量,则可能发生反应2Cu+S
2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量,则可能发生反应2Cu+S![]() Cu2S,黑色固体为Cu2S。
Cu2S,黑色固体为Cu2S。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
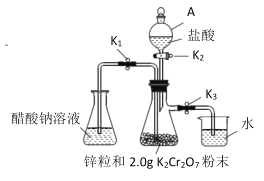
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)