题目内容
【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
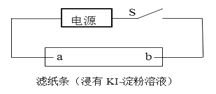
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。
【答案】11 NH4++H2O![]() NH3 ·H2O+ H+ Ag2S B 0.013 A 0.25 增大 负极 2I--2e-= I2
NH3 ·H2O+ H+ Ag2S B 0.013 A 0.25 增大 负极 2I--2e-= I2
【解析】
⑴①常温下,先你0.001mol/LNaOH溶液中氢离子浓度;②(NH4)2SO4酸化原因是铵根水解显酸性;③分别计算沉淀时需要的银离子浓度,需要银离子浓度最少,则最先沉淀。
⑵甲醇是可再生能源,其燃烧热为726.5kJ·mol-1,甲醇燃烧时主要要写状态和水为液体。
⑶①在10-20min内,根据公式计算A的平均反应速率;②A. 密度等于气体质量除以容器体积,气体质量不变,容器体积不变,则容器内气体密度始终不变化,不能作为判断平衡标志;B. 平均摩尔质量等于气体质量除以 物质的量,气体质量不变,气体物质的量减少,平均摩尔质量增大,当容器内气体平均摩尔质量不再变化,则达到平衡;C. 容器内气体的压强不断减小,当不再变化,则达到平衡;③800℃时,先求出平衡时各物质的量浓度,再计算平衡常数;④若温度将为600℃,降低温度,平衡向放热方向移动即正向移动。
⑷可观察到滤纸a端附近呈蓝色,说明生成了碘单质,即a为阳极,b为阴极,滤纸b端与电源正极相连。
⑴①常温下,0.001mol/LNaOH溶液![]() ,pH=11;故答案为:11。
,pH=11;故答案为:11。
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因铵根水解显酸性,离子方程式为是NH4++H2O![]() NH3H2O+ H+;故答案为:NH4++H2O
NH3H2O+ H+;故答案为:NH4++H2O![]() NH3H2O+ H+。
NH3H2O+ H+。
③向KCl溶液沉淀Cl-,需要是银离子浓度![]() ,向K2S溶液沉淀S2-,需要是银离子浓度
,向K2S溶液沉淀S2-,需要是银离子浓度![]() ,
,![]() ,沉淀S2-需要的银离子浓度最小,因此最先产生的沉淀是Ag2S,故答案为:Ag2S。
,沉淀S2-需要的银离子浓度最小,因此最先产生的沉淀是Ag2S,故答案为:Ag2S。
⑵甲醇是可再生能源,其燃烧热为726.5kJ·mol-1,甲醇燃烧的热化学方程式的是CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1;故答案为:B。
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1;故答案为:B。
⑶①在10-20min内,A的平均反应速率为![]() ;故答案为:0.013。
;故答案为:0.013。
②A. 密度等于气体质量除以容器体积,气体质量不变,容器体积不变,则容器内气体密度始终不变化,不能作为判断平衡标志,故A符合题意;B. 平均摩尔质量等于气体质量除以 物质的量,气体质量不变,气体物质的量减少,平均摩尔质量增大,当容器内气体平均摩尔质量不再变化,则达到平衡,故B不符合题意;C. 容器内气体的压强不断减小,当不再变化,则达到平衡,故C不符合题意;综上所述,答案为A。
③800℃时,c(A) = 0.5 molL1,Δc(A) = 0.5 molL1,则平衡时c(B) = 0.5 molL1,c(C) = 0.25 molL1,平衡常数![]() ;故答案为:0.25。
;故答案为:0.25。
④若温度将为600℃,降低温度,平衡向放热方向移动即正向移动,平衡常数K将增大;故答案为:增大。
⑷①可观察到滤纸a端附近呈蓝色,说明生成了碘单质,即a为阳极,b为阴极,滤纸b端与电源正极相连;故答案为:正极。
②滤纸a端生成单质碘,发生的电极反应式为2I--2e-= I2;故答案为:2I--2e-= I2。

 阅读快车系列答案
阅读快车系列答案【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
c(CO)(mol/L) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)反应的Q___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=___。
(3)计算在该温度下,反应的平衡常数K=___。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是___。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | ___ | ___ | ___ | 124 |
Ⅲ | 350 | ___ | ___ | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号___。
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
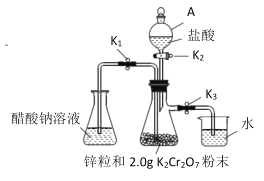
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。