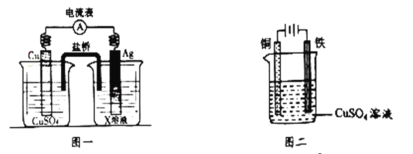
题目内容
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是
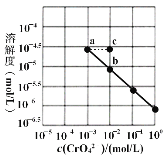
A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
【答案】B
【解析】
A.曲线为达到沉淀溶解平衡时的曲线,a点和b点c(CrO42-)不一样,则c(Ag+)不相同,A错误;
B. 根据图象上相关数据,Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),如以c(CrO42-)=10-2 mol/L时,溶解度为10-5 mol/L计算Ksp=c2(Ag+) c(CrO42-)=(2×10-5)2×10-2=4×10-12,则数量级为10-12,B正确;
2Ag+(aq)+CrO42-(aq),如以c(CrO42-)=10-2 mol/L时,溶解度为10-5 mol/L计算Ksp=c2(Ag+) c(CrO42-)=(2×10-5)2×10-2=4×10-12,则数量级为10-12,B正确;
C. 加热蒸发饱和Ag2CrO4溶液再恢复到25℃,仍然为该温度下的饱和溶液,各种微粒的浓度不变,因此不能使溶液由a点变到b点,C错误;
D. 由于Ksp(AgCl)=1.8×10-10,当溶液中KCl为0.01 mol/L时,形成沉淀需Ag+的浓度最小为c(Ag+)=![]() mol/L=1.8×10-8 mol/L,而Ksp(Ag2CrO4)=4×10-12,形成Ag2CrO4时需要Ag+的浓度最小为c(Ag+)=
mol/L=1.8×10-8 mol/L,而Ksp(Ag2CrO4)=4×10-12,形成Ag2CrO4时需要Ag+的浓度最小为c(Ag+)=![]() mol/L=2×10-5 mol/L,形成沉淀需要的Ag+浓度越小,先形成沉淀,可见等浓度的混合溶液中,Cl-先产生沉淀,D错误;
mol/L=2×10-5 mol/L,形成沉淀需要的Ag+浓度越小,先形成沉淀,可见等浓度的混合溶液中,Cl-先产生沉淀,D错误;
故合理选项是B。

【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
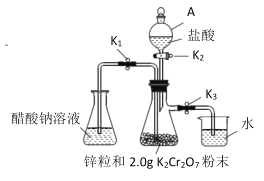
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)