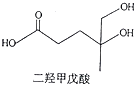
题目内容
【题目】利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理。
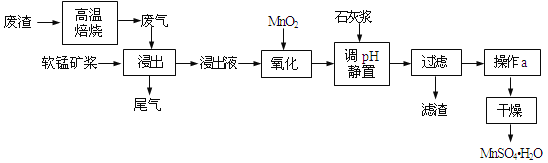
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式_____________________________。为了提高软锰矿的浸取率,可以采取的措施除了充分搅拌外还有:_____________________(至少答两点)。
(2)写出氧化过程中主要反应的离子方程式:_____________________________。
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______。②若加入的石灰浆过多,会使得MnSO4H2O晶体中含有较多杂质,其原因是_____________________________。
(4)下列各组试剂中,能准确测定尾气中SO2含量的是______(选填序号)。
a.NaOH溶液、品红溶液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液
【答案】 SO2+MnO2=MnSO4 适当升温、缓慢通气等 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 4.7~8.3 若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子 bc
【解析】高温焙烧含硫废渣产生的SO2废气,软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+、Ca2+三种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂,然后调节pH值在4.7~8.3间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,过滤,滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,由于制取的MnSO4H2O含有结晶水,故操作a采用蒸发浓缩结晶的方法,得到MnSO4H2O。
(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4,为了提高软锰矿的浸取率,可以采取的措施除了充分搅拌外还可以适当升温、缓慢通气等,故答案为:SO2+MnO2=MnSO4;适当升温、缓慢通气;
(2)杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)①杂质中含有Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可,故答案为:4.7~8.3;
②若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子(或Al(OH)3+OH-═AlO2-+2H2O);
(4)a.二氧化硫和氢氧化钠反应生成亚硫酸钠,亚硫酸钠和二氧化硫、水又能反应生成亚硫酸氢钠,有两步反应,所以无法准确测定尾气中SO2含量,故a错误;b.稀H2SO4酸化的KMnO4溶液和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故b正确;c.碘和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故c正确;故答案为:bc。