题目内容
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
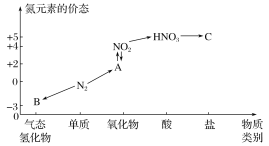
(1)写出N2的两种用途:_________、____。常用作制冷剂的化合物是________(名称)。该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是_________。
(2)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为_______。
(3)NO2与水反应生成物质A的离子方程式为______________。
(4)浓硝酸与木炭在加热条件下反应的化学方程式为___________________。
(5)氨水显碱性,写出氨水的电离方程式______________________________;
(6)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:_______。
【答案】做保护气、 保存粮食、制氨气等 氨气 NH3+HCl=NH4Cl AgNO3 3NO2 +H2O=2H++2NO3- +NO C+4HNO3(浓)![]() CO2+4NO2 +2H2O NH3·H2ONH4++OH- 4NH3+5O2
CO2+4NO2 +2H2O NH3·H2ONH4++OH- 4NH3+5O2 4NO+6H2O
4NO+6H2O
【解析】
B为-3价氮元素的气态氢化物,B为NH3;A为+2价氮元素的氧化物,与NO2相互转化,A为NO;C为某种硝酸盐。
(1)氮气不活泼且性质较稳定,所以可作保护气,能保存粮食,可以制备氨气等;氨气常用作制冷剂;氨气与HCl气体在空气中相遇生成氯化铵固体产生白烟,方程式为NH3+HCl=NH4Cl;
(2)检验氯离子常用硝酸酸化的硝酸银溶液,则C为AgNO3;
(3)NO2与水发生歧化反应,离子方程式为3NO2 +H2O=2H++2NO3- +NO;
(4)在加热条件下浓硝酸可木炭氧化成二氧化碳,浓硝酸被还原成NO2,方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑ +2H2O;
CO2↑+4NO2↑ +2H2O;
(5)一水合氨为弱电解质,在水溶液中部分电离,电离方程式为NH3·H2ONH4++OH-;
(6)氨催化氧化生成NO,反应中氧气做氧化剂,结合电子守恒和元素守恒可知方程式为:4NH3+5O2 4NO+6H2O。
4NO+6H2O。

【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.61×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是__(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是_。
A.c(H+) B.c(H+)c(CH3COO-) C.c(H+)c(OH-) D.![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1__V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是__。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)25℃时,0.1mol/L CH3COOH溶液的pH约为3,向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①__;②__;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L CH3COOH溶液中加入少量下列物质中的__(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(8)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈__性;
(9)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:___。
【题目】1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这个电子。请回答:

(1)臭氧与氧气的关系是_____________。
(2)写出下列分子与O3分子的结构最相似的是_______________。
A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有________对孤对电子。
(4)O3分子是否为极性分子____________(填是或否)。
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
_____PbS +___O3=________PbSO4+_______O2
生成1mol O2的转移电子物质的量为___________mol。